
����Ŀ����֪ij���巴Ӧ��ƽ�ⳣ���ɱ�ʾΪK=![]() ���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ����400�棬K=32��500�棬K=44����ش��������⣺
���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ����400�棬K=32��500�棬K=44����ش��������⣺
��1��д��������Ӧ�Ļ�ѧ����ʽ____��
��2����֪���ܱ������У����ijʱ�̸���ֵ�Ũ�����£�
���� | CH3OH(g�� | CH3OCH3(g�� | H2O(g�� |
Ũ��/��molL-1�� | 0.54 | 0.68 | 0.68 |
�ٴ�ʱ�¶�400�棬��ijʱ������____���������������ͬ����
�������¶�Ϊ�����꣬�Ը��¶���ƽ��̬�״����ʵ���nΪ�����꣬��ʱ��Ӧ����ͼ���λ����ͼ��___�㣬�Ƚ�ͼ��B��D��������Ӧ������Ӧ������B_____��D��������____��

��3��һ��������Ҫ��߷�Ӧ���ת���ʣ����Բ��õĴ�ʩ��___��
a�������¶� b��������� c��ѹ����������� d������ˮ������Ũ�� e����ʱ���������
���𰸡�2CH3OH![]() CH3OCH3+H2O > A < �¶����ߣ���ѧ��Ӧ���ʼӿ� ae
CH3OCH3+H2O > A < �¶����ߣ���ѧ��Ӧ���ʼӿ� ae
��������
��1����ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ����÷�Ӧ�ķ�Ӧ��Ϊ�״���������Ϊ�����Ѻ�ˮ��
��2�����¶�400��ʱ��ijʱ��Ũ����QcС��ƽ�ⳣ��������ƽ��������Ӧ�����ƶ���
��ƽ��������Ӧ�����ƶ����״��İٷֺ�������ƽ��ʱ�ĺ������¶�Խ�߷�Ӧ����Խ��
��3�����ݻ�ѧƽ���ƶ�ԭ�������жϡ�
��1����ƽ�ⳣ���ɱ�ʾΪK=![]() ��֪���÷�Ӧ�ķ�Ӧ��Ϊ�״���������Ϊ�����Ѻ�ˮ����Ӧ�Ļ�ѧ����ʽΪ2CH3OH��g��
��֪���÷�Ӧ�ķ�Ӧ��Ϊ�״���������Ϊ�����Ѻ�ˮ����Ӧ�Ļ�ѧ����ʽΪ2CH3OH��g��![]() CH3OCH3��g��+H2O��g�����ʴ�Ϊ��2CH3OH��g��
CH3OCH3��g��+H2O��g�����ʴ�Ϊ��2CH3OH��g��![]() CH3OCH3��g��+H2O��g����
CH3OCH3��g��+H2O��g����
��2�����¶�400��ʱ��ijʱ��Ũ����Qc=![]() =
=![]() =1.55��32����ƽ��������Ӧ�����ƶ���v����v�����ʴ�Ϊ��>��
=1.55��32����ƽ��������Ӧ�����ƶ���v����v�����ʴ�Ϊ��>��
���ɢٿ�֪ƽ��������Ӧ�����ƶ������Լ״��İٷֺ�������ƽ��ʱ�ĺ�������ʱ��Ӧ��Ӧ��A�㣻����Ӱ�컯ѧ��Ӧ���ʵ����أ��¶�Խ�߷�Ӧ����Խ��D���¶ȸ���B�㣬����D���Ӧ������Ӧ����Ҳ����B�㣬�ʴ�Ϊ��A�������¶����ߣ���ѧ��Ӧ���ʼӿ죻
��3��a������Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ����״���ƽ��Ũ�ȼ�С��ת����������ȷ��
b�����������ƽ�ⲻ�ƶ����״���ת���ʲ��䣬�ʴ���
c���÷�ӦΪ�����������ķ�Ӧ��ѹ�����������ѹǿ����ƽ�ⲻ�ƶ����״���ת���ʲ��䣬�ʴ���
d������ˮ����Ũ�ȣ�ƽ�����淴Ӧ�����ƶ����״���ת���ʼ�С���ʴ���
e����ʱ������ƽ��������Ӧ�����ƶ����״���ת����������ȷ��
ae��ȷ���ʴ�Ϊ��ae��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[���ʽṹ������]
[Zn(CN)4]2�C��ˮ��Һ����HCHO�������·�Ӧ��
4HCHO+[Zn(CN)4]2�C+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
��1��Zn2+��̬��������Ų�ʽΪ____________________��
��2��1 mol HCHO�����к�����������ĿΪ____________mol��
��3��HOCH2CN������̼ԭ�ӹ�����ӻ�������______________��
��4����H2O���ӻ�Ϊ�ȵ������������Ϊ________________��
��5��[Zn(CN)4]2�C��Zn2+��CN�C��Cԭ���γ���λ���������ǿռ乹�ͣ�[Zn(CN)4]2�C�Ľṹ����ʾ��ͼ��ʾΪ_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������[Co(H2PO2)2]�㷺Ӧ���ڻ�ѧ��ƣ���ҵ�����õ���������ȡ�������ܵ�ԭ��ͼ��ͼ��ʾ��
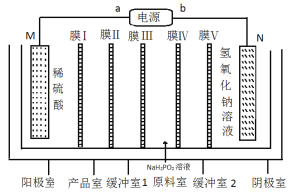
��֪���ٸ�װ�õĵ缫���Ϸֱ�Ϊ�����ܺͲ���֡�
��Co(H2PO2)2��Һ��ǿ����������ͨ������������������ԭ��Ӧ��ʵ�ֻ�ѧ���ܡ�
����˵������ȷ���ǣ� ��
A.Ĥ��Ĥ���Ϊ�����ӽ���Ĥ
B.M�缫��ӦΪCo-2e-+2H2PO2-=Co(H2PO2)2
C.aΪ��Դ�ĸ���
D.Co(H2PO2)2��Һ��ѧ���ܹ����з�Ӧ����ΪCo2++H2PO2-+3OH=Co+HPO3-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������CO2��CH4ת��Ϊ�߸���ֵ��ƷCH3COOH�Ĵ���Ӧ���̡�������ʾ��ͼ���¡�
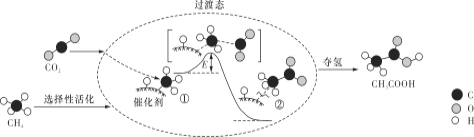
����˵������ȷ����
A. ����CH3COOH�ܷ�Ӧ��ԭ��������Ϊ100%
B. CH4��CH3COOH����������C�DH����������
C. �١����ų��������γ���C�DC��
D. �ô�������Ч��߷�Ӧ���ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ���

A. ͼ�ٱ�ʾN2O4(g)![]() 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL0.01 mol/LKMnO4������Һ�����0.1mol/LH2C2O4��Һ���ʱ��n(Mn2+)��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+H2(g)![]() CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�á����ᱵ����ľ����ṹʾ��ͼ��ͼ��ʾ�����Ļ�ѧʽ��
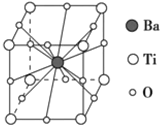
A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ����ɵĻ����������Ӿ��壬�侧����ͼ��ʾ��X��Y��Z�ֱ���������Ķ��㡢��ߵ��е㡢����������ġ���������ڸû������˵����ȷ����(����)
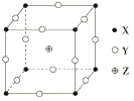
A. �þ���Ļ�ѧʽΪZXY3
B. �þ�����۵�һ���Ƚ��������۵��
C. ÿ��X��Χ���������Y��8��
D. ÿ��Z��Χ���������X��16��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʢ��Һ����Լ�ƿ����ͼ����ϸ�۲�ֳ������Ե����ࡢ����Һ���Һ�������࣬����˵���������( )

A.������ֺ���ɫ����Ϊ���к���Br2������
B.����Һ���������ԣ���Ҫ��ΪHBr�������H![]()
C.Һ�屣��ʱ��ˮ�γ�ˮ���Ŀ���Ǽ���Br2�Ļӷ�
D.Һ�屣��ʱ���ɳ��ڷ��ã�Ӧ������ϸ��ƿ�в���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ������Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ�����ݸñ����ش��������⣺
��ѧʽ | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
����ƽ�� ������Ka�� | 4.0��10-4 | 1.8��10-5 | K1=1.54��10-2 K2=1.02��10-7 | K1=4.4��10-7 K2=4.7��10-11 | K1��9.1��10��8 K2��1.1��10��12 |
(1)ͬŨ�ȵ�F����CO32-��CH3COO-��HS-���H����������ǿ��Ϊ__________
(2)��Һ�в����ܴ����������������__________
a��HS-��SO32- b��HF��CH3COO- c��HS-��HCO3- d. HSO3-��HCO3-
(3)Na2CO3��Һͨ�����H2S�����ӷ���ʽ�ǣ�_____��
(4)OH��Ũ����ͬ�ĵ������������ҺHCl��A���� CH3COOH��E�����ֱ���п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ����_______(��д���)��
�ٷ�Ӧ����Ҫ��ʱ��E>A �ڿ�ʼ��Ӧʱ������A>E
�۲μӷ�Ӧ��п�����ʵ���A��E �ܷ�Ӧ���̵�ƽ������E>A
��A��Һ����пʣ�� ��E��Һ����пʣ��
(5)�� 0.l molL-1 CH3COOH��Һ�еμ� NaOH ��Һ��c(CH3COOH) : c(CH3COO-) =2 : 36����ʱ��ҺpH = __________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com