
【题目】实验室用图所示装置制备KClO溶液,并通过KClO溶液与![]() 溶液的反应制备高效水处理剂
溶液的反应制备高效水处理剂![]() 已知
已知![]() 具有下列性质
具有下列性质![]() 可溶于水、微溶于浓KOH溶液,
可溶于水、微溶于浓KOH溶液,![]() 在
在![]() 、强碱性溶液中比较稳定,
、强碱性溶液中比较稳定,![]() 在
在![]() 和
和![]() 催化作用下发生分解,
催化作用下发生分解,![]() 在酸性至弱碱性条件下,能与水反应生成
在酸性至弱碱性条件下,能与水反应生成![]() 和
和![]() 。
。
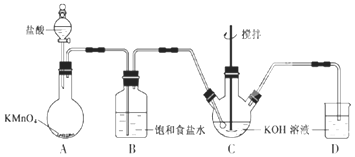
(1)装置A中![]() 与盐酸反应生成
与盐酸反应生成![]() 和
和![]() ,其化学方程式为______,装置B的作用是______。
,其化学方程式为______,装置B的作用是______。
(2)![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,试写出该反应的离子方程式______。
,试写出该反应的离子方程式______。
(3)制备![]() 时,KClO饱和溶液与
时,KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
(4)已知![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 下表列出了几种离子生成氢氧化物沉淀的
下表列出了几种离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
开始沉淀的pH | 沉淀完全的pH | |
|
|
|
|
|
|
|
|
|
实验中可选用的试剂:![]() 、
、![]() 、
、![]() 由某硫酸锌溶液
由某硫酸锌溶液![]() 含
含![]() 、
、![]() 杂质
杂质![]() 制备ZnO的实验步骤依次为:
制备ZnO的实验步骤依次为:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。
【答案】2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 除去![]() 中的HCl
中的HCl 
![]() 在
在![]() 作用下会分解 向硫酸锌溶液中加入适量
作用下会分解 向硫酸锌溶液中加入适量![]() ,使其充分反应 滴加
,使其充分反应 滴加![]() ,调节溶液pH约为
,调节溶液pH约为![]() 或
或![]() ,使
,使![]() 沉淀完全 向滤液中滴加
沉淀完全 向滤液中滴加![]() ,调节溶液pH约为
,调节溶液pH约为![]() 或
或![]() ,使
,使![]() 沉淀完全
沉淀完全
【解析】
根据实验装置图可知,A装置 中用高锰酸钾与盐酸反应制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钠,反应的尾气氯气用氢氧化钾吸收。
![]() 具有强氧化性,将盐酸中氯离子氧化为
具有强氧化性,将盐酸中氯离子氧化为![]() ,反应还有水生成,所以化学方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
,反应还有水生成,所以化学方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;除去![]() 中的HCl;
中的HCl;
![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,反应的离子方程式为
,反应的离子方程式为 ,故答案为:
,故答案为: ;
;
![]() 由题意可知
由题意可知![]() 在
在![]() 和
和![]() 催化作用下发生分解,则KClO饱和溶液与
催化作用下发生分解,则KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中,故答案为:
饱和溶液缓慢滴加到KClO饱和溶液中,故答案为:![]() 在
在![]() 作用下会分解;
作用下会分解;
![]() 根据表中阳离子沉淀的PH可知,由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入
根据表中阳离子沉淀的PH可知,由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入![]() ,使其充分反应,目的使
,使其充分反应,目的使![]() 转化完全为
转化完全为![]() ,②加氢氧化钠溶液,控制PH在4左右,使
,②加氢氧化钠溶液,控制PH在4左右,使![]() 沉淀完全,③过滤,④向滤液中滴加
沉淀完全,③过滤,④向滤液中滴加![]() ,调节溶液PH约为
,调节溶液PH约为![]() 或
或![]() ,使
,使![]() 沉淀完全,
沉淀完全,![]() 过滤、洗涤、干燥,⑥900℃煅烧。故答案为:①向硫酸锌溶液中加入适量
过滤、洗涤、干燥,⑥900℃煅烧。故答案为:①向硫酸锌溶液中加入适量![]()
![]() ,使其充分反应;②滴加
,使其充分反应;②滴加![]()
![]() ,调节溶液pH约为
,调节溶液pH约为![]() 或
或![]() ,使
,使![]() 沉淀完全;④向滤液中滴加
沉淀完全;④向滤液中滴加![]()
![]() ,调节溶液pH约为
,调节溶液pH约为![]() 或
或![]() ,使
,使![]() 沉淀完全。
沉淀完全。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
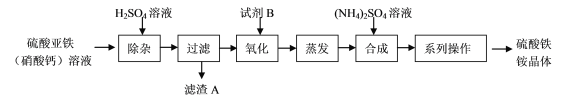
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4C1晶体析出。
(1)如图所示装置的连接顺序是:a接__;__接__;b接__(填接口编号)。

(2)A中常选用的固体反应物为___;D中应选用的液体为__。
(3)第二步中必须先让___装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是___;装有无水CaCl2的U形管的作用是__。
(5)第三步分离出NaHCO3固体的操作是__。
(6)第四步中所加固体粉末化学式为___;所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,证明所得晶体大部分是NH4C1。简要写出操作和现象:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】
①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
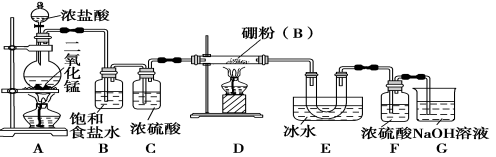
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:______________。
(2)E装置的作用是________________。
(3)写出D装置中发生反应的化学方程式:__________________;实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式________________。
(5)为了顺利完成实验,正确的操作是__________(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
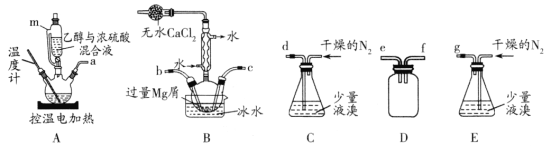
已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。
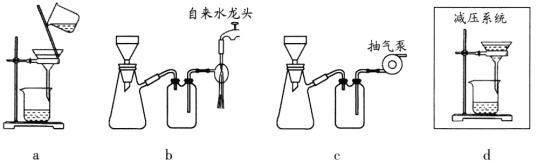
(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
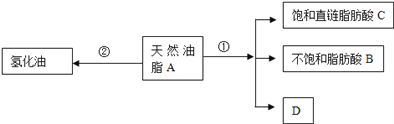
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
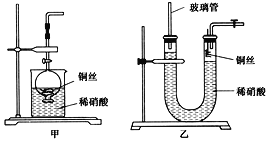
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
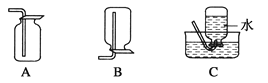
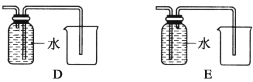
合理的是________(填选项代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。

(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:

①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
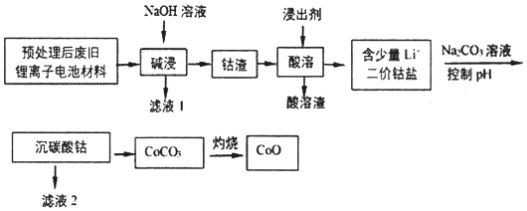
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com