
����Ŀ��Ǧ���仯������������ء������豸��X���߷������ϣ���֪Pb�Ļ��ϼ�ֻ��0��+2��+4���ش��������⣺
��1��PbO2��PbO�Ļ�����У�Pb��O�����ʵ���֮��Ϊ8��11���������У�PbO2��PbO�����ʵ���֮��Ϊ_____��
��2����������CO��ԭ13.7gijǦ����������ɵ�CO2ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ��ij������������Ϊ8.0g�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪ_____��
���𰸡�3��5 Pb3O4
��������
��1����������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol����x+y������2x+y����8��11����֮��x��y��3��5��
�ʴ�Ϊ3��5��
��2���������������8.0gΪ̼���������
����̼��Ƶ����ʵ���Ϊ��![]() ��0.08mol��
��0.08mol��
Ǧ�������е���ԭ�ӱ�CO��ȡ����CO2��
����̼Ԫ�ء���Ԫ���غ��֪CO������O������CO2������CaCO3��
1 1 1
0.08mol 0.08mol 0.08mol
Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ��0.08mol��16g/mol��1.28g��Ǧ�������е�ǦԪ�ص�����Ϊ��13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ��![]() ��0.06mol��
��0.06mol��
��Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮�ȣ�0.06mol��0.08mol��3��4��
��Ǧ������Ļ�ѧʽΪPb3O4��
�ʴ�Ϊ��Pb3O4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.��״����2.24LCO2ͨ��1mol/L100mLNaOH��Һ�У�CO2+OH-��HCO3-
B.�������������������Fe(OH)3+3H+��Fe3++3H2O
C.Na2Sˮ�⣺S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.�����ʵ�����NH4HCO3��NaOH����Һ�з�Ӧ��NH4++HCO3-+2OH-��CO32-+NH3+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2������)Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Na2Cr2O7��2H2O)������Ҫ�����������£�
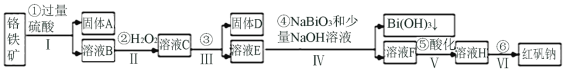
�������ϵ�֪��
���������£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��Ϊ![]() ��
��
����
�������� | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
��ʼ������pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
������ȫ��pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
�ش��������⣺
(1)Fe��Ԫ�����ڱ��е�λ��______________________________����Ӧ֮ǰ�Ƚ���ʯ�����Ŀ����__________________��
(2)����ۼӵ��Լ�Ϊ_____________����ʱ��ҺpHҪ����5��Ŀ��______________��
(3)д����Ӧ�ܵ����ӷ�Ӧ����ʽ______________________��
(4)�����ữ��ʹ![]() ת��Ϊ
ת��Ϊ![]() ��д���÷�Ӧ�����ӷ���ʽ_________________��
��д���÷�Ӧ�����ӷ���ʽ_________________��
(5)����ҺH��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ����T�ú췯�ƴ־��壬���ƺ췯����Դ־�����Ҫ���õIJ�����__________________(���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol���ף�P4��s����4mol���ף�P��s����������Ӧ�����е������仯��ͼ��E��ʾ������������˵����ȷ���ǣ� ��
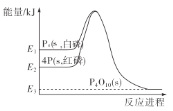
A. P4(s������)=4P(s������) ��H��0
B. ���ϱ仯�У����ͺ������������
C. ���ױȺ����ȶ�
D. ����ȼ�յ��Ȼ�ѧ����ʽ��4P(s������)��5O2(g)��P4O10(s) ��H=��(E2��E3)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KMnO4����������Һ����Ӧ����ʽ��2KMnO4+16HCl===2KCl+2MnCl2+5Cl2��+8H2O����������Cl2�ڱ�״�������Ϊ56 L�����㣺
(1)�μӷ�Ӧ��HCl�����ʵ���________________
(2)��Ӧ�б�������HCl�����ʵ���__________________
(3)����˫���ű������ת�Ƶķ������Ŀ___________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��B�ǵ������ڵ�����Ԫ�أ�B�����ڱ������ڽ���Ԫ��A��C��D��E��λ����ͼ��ʾ����֪������Ԫ�صĺ˵����֮��Ϊ85���ش��������⣺
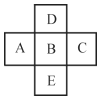
��1��BԪ�ص�ԭ��������_____��ԭ�ӽṹʾ��ͼ��_____��
��2��A��B��C����Ԫ�صķǽ�������ǿ������˳����_____�����ǵ�����������ˮ���������������ǿ��˳����_____�����û�ѧʽ��ʾ��
��3��B��D��E����Ԫ�صķǽ�������ǿ������˳����_____�����ǵ��⻯��Ļ�ԭ��������ǿ��˳����_____���û�ѧʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 3 �������Ϊ 2.0 L �ĺ����ܱ������У���ӦH2O(g) + C(s)![]() CO(g) + H2(g) ��H > 0�ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
CO(g) + H2(g) ��H > 0�ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
���� | �¶� ��T1>T2�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.���¶�Ϊ T1ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��ֵΪ 0.25
B.�� 5min ������ I �дﵽƽ�⣬�� 5min �ڵ�ƽ����Ӧ���ʣ�v(H2) = 0.05mol��L-1��min-1
C.�ﵽƽ��ʱ������ II ��H2O��ת���ʱ����� I �е�С
D.�ﵽƽ��ʱ������ III �е� CO ��ת����С�� 50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ת�������������������ԭ������(����)
A. NO2��HNO3��NO B. ![]() ��NH3
��NH3
C. NH3��NO D. P2O5��H3PO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶�һֱ�ǿ�ѧ���о�����Ҫ���⣬�ϳɰ������˹��̵��Ƚϳ���ļ�������ԭ��ΪN2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)��֪ÿ�ƻ�1mol�йػ�ѧ����Ҫ���������±���
H-H | N-H | N-N | N��N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)��Ӧ���������_________(����>���� ��<��)�������������
(2)��һ���¶��¡���2L�ܱ������м���2 molN2��6 mol H2�����ʵ��Ĵ��������£�������Ӧ N2 (g)+3H2 (g)![]() 2NH3(g)��10min��ﵽƽ�⣬��ʱʣ��4.5mol H2��
2NH3(g)��10min��ﵽƽ�⣬��ʱʣ��4.5mol H2��
������������˵���˷�Ӧ�ﵽƽ��״̬����________________________��
a����������ѹǿ���� b��v(H2)����v(H2)���� c��N2��H2��Ũ�����
d�� 2 mol NH3���ɵ�ͬʱ��3 moH��H������ e��NH3��Ũ�Ȳ��ٸı�
��0��10 min�ڵ�ƽ����Ӧ����v(H2) ��______mol/(Lmin)��10��ĩNH3��Ũ����______mol/L��N2 �ĵ����ʵ���________mol
��ij�¶�ʱ����һ��2L���ܱ�������X��Y��Z�����������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ���ݴ˻ش�
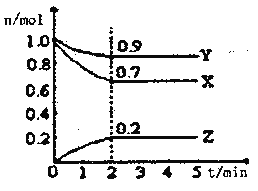
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_______________________
(2)�ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ____________mol/(L��min)��
(3)�ı��������������Լӿ컯ѧ��Ӧ���ʵ���_________
A�������¶� B����С����X�����ʵ���
C����Сѹǿ D����������Z�����ʵ���.
E������ij�ִ��� F.��С�ݻ� G��ʹ��Ч�ʸ��ߵĴ���
(4)�÷�Ӧ����Ϊ���ȷ�Ӧ����������Ϊ��������(��������Ƚ���)����ƽ������ʱ�佫_________��
a���ӳ� b������ c������ d����ȷ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com