
| 112×59.7% |
| 16 |
| 160×59.7% |
| 16 |
| 16×5 |
| 59.7% |
| 112×59.7% |
| 16 |
| 160×59.7% |
| 16 |
| 16×5 |
| 59.7% |
| 44.8L |
| 22.4L/mol |
| 33.6L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、28.58kJ |
| B、82.16 kJ |
| C、53.58 kJ |
| D、89.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fel2+Cl2=2FeCl3 |
| B、CaO+H2O=Ca(OH)2 |
| C、2H2O2=2H2O+O2 |
| D、Cl2+2NaBr=2NaCl+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 2 |
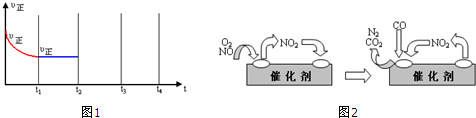
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
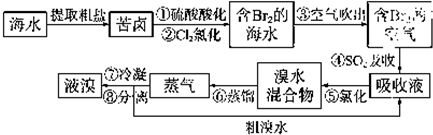
查看答案和解析>>
科目:高中化学 来源: 题型:
| 灼烧 |
| 浸泡 |
| ① |
| ② |
| 适量Cl2 |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com