

| A. | ab | B. | bc | C. | cd | D. | bd |
分析 a.平衡常数与温度有关,温度不变,则平衡常数始终不变;
b.t1时刻NO与二氧化碳物质的量相等,而后NO物质的量减小、二氧化碳物质的量增大,故t1时刻反应向正反应进行;
c.NO、CO二者按1:1反应,随反应进行n(NO):n(CO)增大,二者之比不再变化,说明到达平衡;
d.t3时刻起反应物的转化率不变,说明到达平衡.
解答 解:a.平衡常数与温度有关,温度不变,则平衡常数始终不变,平衡常数不能说明到达平衡,故错误;
b.t1时刻NO与二氧化碳物质的量相等,而后NO物质的量减小、二氧化碳物质的量增大,故t1时刻反应向正反应进行,故错误;
c.起始n(NO):n(CO)=2:1,二者按1:1反应,随反应进行n(NO):n(CO)增大,二者之比不再变化,说明到达平衡,故正确,
d.随反应进行反应物转化率增大,t3时刻起反应物的转化率不变,说明到达平衡,故正确;
故选:C.
点评 本题考查化学平衡状态特征需要学生具备扎实的基础,注意对平衡特征的理解掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 海盐经过溶解、过滤、蒸发制纯净的NaCl | |
| C. | CO2气体混有少量HCl气体,将气体通过盛有饱和Na2CO3中溶液的洗气瓶以除去HCl气体 | |
| D. | 分液操作时,分液漏斗中先把下层液体从下口放出,再把上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe3+、SCN-、Cl- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Fe2+、K+、Cl-、SO42- | D. | Na+、H+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
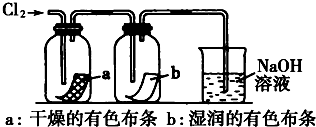
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com