
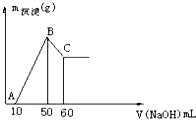
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )| A、盐酸的物质的量浓度为0.5mol?L-1 |
| B、合金中铝的物质的量为0.01mol |
| C、合金中镁的物质的量为0.005mol |
| D、B点与C点沉淀的物质的量之比为2:1 |
| n |
| V |
| 0.05mol |
| 0.1L |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
A、Ba2+、Cl-、C
| ||||
B、N
| ||||
C、Na+、H+、S
| ||||
D、Fe2+、H+、N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18g/mol |
| B、CH4的摩尔质量为16g |
| C、3.01×1023个SO2分子的质量为32g |
| D、摩尔是国际单位制中的一个基本物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3 mol O2和0.3 mol H2O |
| B、0.1 mol H2SO4和3.6 g H2O |
| C、0.1 mol MgSO4?7H2O和0.1 mol C12H22O11(蔗糖) |
| D、6.02×1023个CO2与0.1 mol KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 |
| B、倒入漏斗的过滤液的液面应低于滤纸边缘 |
| C、用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 |
| D、称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸亚铁溶液中滴加硫氰化钾溶液 |
| B、稀醋酸溶液中滴加酚酞指示剂 |
| C、硫酸铜溶液中滴加硝酸钡溶液 |
| D、溴水中滴加亚硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电能力不一定比弱电解质强 |
| B、冰醋酸是弱电解质,液态时能导电 |
| C、盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 |
| D、相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L 氨水中NH4+的浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度时H+浓度增大 |
| B、加水稀释时平衡向右移动 |
| C、加入少量NaOH时溶液pH减小 |
| D、溶液中水电离出的H+浓度等于OH-浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com