

 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:058
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华.如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答:

(1)B中反应的化学方程式为:________.
(2)D中反应开始前,需排除装置中的空气,应采取的方法是:________
(3)D中反应的化学方程式为:________.
(4)装置(Ⅰ)的主要缺点是:________.
(5)装置(Ⅱ)的主要缺点是________,如果选用此装置来完成实验,则必须采取的改进措施是:________.
查看答案和解析>>
科目:高中化学 来源:中学教材全解 高中化学必修2(配山东科学技术出版社实验教科书) 山东科学技术出版社实验教科书 题型:058
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色,易潮解,100℃左右升华.如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答:

(1)B中反应的化学方程式为________.
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是________.
(3)D中反应的化学方程式为________.
(4)装置(Ⅰ)的主要缺点是________.
(5)装置(Ⅱ)的主要缺点是________.
如果选用此装置来完成实验,则必须采取的改进措施是________.
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高二(上)期末化学试卷(解析版) 题型:解答题
 O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1 O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | △H1=-23.1 | |
| B | 0.9 | 2.7 | 0.2 | △H2 |
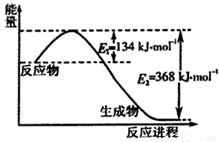
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com