
(14分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+O2(g) ⊿H >0
2H2(g)+O2(g) ⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(1)铜或Cu(1分) (2)2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=1/2(2a—b—c) kJ·mol-1(2分) (3)2Cu-2e-+2OH-=Cu2O+H2O(2分)
(4)4Cu(OH)2+N2H4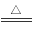 2Cu2O+N2↑+6H2O(3分)
2Cu2O+N2↑+6H2O(3分)
(5)过滤(2分) (6)3.5×10-5 mol·L-1 min-1(2分) <(1分) <(1分)
【解析】
试题分析:(1)碳在高温下还有氧化铜也可能生成铜而使Cu2O产率降低。
(2)方法Ⅰ制备过程会产生有毒气体,该气体是CO。已知:① C(s)+O2(g)=CO2(g) △H=akJ·mol—1;②2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;③2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1,则根据盖斯定律可可知(2×①—②—③)÷2即得到2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=1/2(2a—b—c) kJ·mol-1。
(3)电解池中阳极失去电子,铜与电源的正极相连,做阳极,则阳极电极反应式为2Cu-2e-+2OH-=Cu2O+H2O。
(4)用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。其中氮元素化合价从—2价升高到0价,铜元素化合价从+2价降低到+1价,因此根据电子得失守恒可知该制法的化学方程式为4Cu(OH)2+N2H4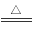 2Cu2O+N2↑+6H2O。
2Cu2O+N2↑+6H2O。
(5)颗粒过大,则可以通过过滤的方法分离。
(6)根据表中数据可知前20 min内消耗水蒸气的浓度是0.050mol/L—0.0486mol/L=0.0014mol/L,则根据方程式可知生成氧气的浓度是0.0007mol/L,则平均反应速率 ν(O2)=0.0007mol/L÷20min=3.5×10-5 mol·L-1 min-1。根据实验②③中数据可知平衡甲醇的浓度分别是0.048mol/L、0.090mol/L,则消耗甲醇的浓度分别是0.002mol/L、0.01mol/L,则生成为的浓度分别均是0.002mol/L、0.01mol/L,所以平衡常数分别是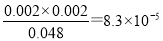 、
、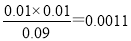 ,这说明温度为T2时平衡常数大。由于正方应是吸热反应,升高温度平衡常数增大,所以T1<T2。实验①、②值起始浓度相等,但到达平衡的时间实验②小于实验①,则催化剂的催化效率:实验①<实验②。
,这说明温度为T2时平衡常数大。由于正方应是吸热反应,升高温度平衡常数增大,所以T1<T2。实验①、②值起始浓度相等,但到达平衡的时间实验②小于实验①,则催化剂的催化效率:实验①<实验②。
考点:考查考查盖斯定律应用、外界条件对平衡状态影响、反应速率计算以及电化学原理应用等


科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH-+ 2HCO3- = CaCO3↓+CO32-+2H2O
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:填空题
(6分)酸、碱、盐在溶解于水或受热熔化时能够 出自由移动的离子,所以它们在水溶液里或熔化状态下能够导电。人们从这个角度对化合物进行分类,酸、碱、盐属于 。酸、碱、盐在水溶液中相互间发生的反应都有离子参加,这样的反应叫做 反应。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
下列各组微粒,在溶液中能大量共存的是
 A.K+、H+、NO3-、Cl- B.Cu2+、Cl-、OH-、SO42-
A.K+、H+、NO3-、Cl- B.Cu2+、Cl-、OH-、SO42-
C.H+、Na+、HCO3-、Cl- D.Ca2+、Cl-、K+、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
下列气体有颜色和有刺激性气味的是
A.CO2 B.Cl2 C.O2 D.CO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大。F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体。A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,金属性最强的元素在周期表的位置是________写出D元素的原子结构示意图________
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈___性,原因________(离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因______________________________________________
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:____________________
检验该二价离子没有被完全氧化的方法为:_______________________________
(4).E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.含有是食品添加剂的食物对人体健康均有害
B.普通玻璃和氮化硅陶瓷都属于新型无机非金属材料
C.大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是

选项 | x | y |
A | 降温 | A的体积分数 |
B | 升高温度 | 混合气体的密度 |
C | 再加入A | B的转化率 |
D | 再加入C | A的体积分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com