
【题目】下列说法正确的是( )

A. 图a曲线,a、b、c三点对应的KW依次增大,且可通过增加c(H+)实现转化
B. 图a曲线,b点下的温度,将pH=2的H2SO4与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 图b曲线,用0.010 0 molL1硝酸银滴定浓度均为0.1000 molL1 A-、B-及C-的混合溶液,首先沉淀的是A-
D. 图b曲线,Ksp(AgA)<Ksp(AgB)<Ksp(AgC),故任何条件下AgB沉淀不能转化为AgC
【答案】C
【解析】
A项、图a曲线,a、c、b三点对应的KW依次增大,此三点对应的温度不同,无法通过增加c(H+)实现转化,故A错误;
B项、处在b点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=12的KOH中c(OH-)=1molL-1,等体积混合氢氧根离子过量,溶液显碱性,故B错误;
C项、由b曲线可知,银离子浓度相等时,阴离子浓度的大小顺序为c(A-)<c(B-)<c(C-),溶度积Ksp(AgA)<Ksp(AgB)<Ksp(AgC),则用0.010 0 molL1硝酸银滴定浓度均为0.1000 molL1 A-、B-及C-的混合溶液,首先沉淀的是A-,故C正确;
D项、由b曲线可知,溶度积Ksp(AgA)<Ksp(AgB)<Ksp(AgC),增大溶液中c(C-),AgB沉淀可能转化为AgC,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2+2CO2=2Na2CO3+O2
D.铁在氯气中燃烧产生棕红色的烟:Fe+Cl2=FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(![]() )悬浊液静置,取上层清液,再通入
)悬浊液静置,取上层清液,再通入![]() ,溶液中尿酸的浓度
,溶液中尿酸的浓度![]() 与
与![]() 的关系如图所示。己知:
的关系如图所示。己知:![]() ,
,![]() ,下列说法正确的是
,下列说法正确的是

A. 上层清液中,![]()
B. 当![]() 时,
时,![]()
C. 在![]() 的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
D. 当![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. N室发生的电极反应式为:2H++2e-=H2↑
B. M室中稀硫酸可用盐酸替代
C. b膜为阴膜,产品室发生的反应方程式为:B(OH)4-+H+=H3BO3+H2O
D. 理论上每生成1mol产品,阳极室可生成标况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A. 碘与干冰分别受热变为气体
B. 硝酸铵与硝酸分别受热变为气体
C. 氯化钠与氯化氢分别溶解在水中
D. 晶体钠与冰分别受热熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
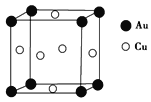
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。

① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com