
| A. | 38.5mol/L | B. | 32.7mol/L | C. | 20.4mol/L | D. | 18.4mol/L |
分析 假设水的体积是1L,则氨气体积为700L,氨气的物质的量=$\frac{700L}{22.4L/mol}$,氨气质量=$\frac{700L}{22.4L/mol}$×17g/mol,水的质量为1000g,溶液质量=$\frac{700L}{22.4L/mol}$×17g/mol+1000g,溶液体积=$\frac{\frac{700}{22.4}mol×17g/mol×1000g}{0.9×1{0}^{3}g/L}$,根据c=$\frac{n}{V}$计算氨水物质的量浓度.
解答 解:假设水的体积是1L,则氨气体积为700L,氨气的物质的量=$\frac{700L}{22.4L/mol}$,氨气质量=$\frac{700L}{22.4L/mol}$×17g/mol,水的质量为1000g,溶液质量=$\frac{700L}{22.4L/mol}$×17g/mol+1000g,溶液体积=$\frac{\frac{700}{22.4}mol×17g/mol×1000g}{0.9×1{0}^{3}g/L}$,氨水物质的量浓度c=$\frac{n}{V}$=$\frac{\frac{700L}{22.4L/mol}}{\frac{\frac{200}{22.4}mol×17g/mol+1000g}{0.9×1{0}^{3}g/L}}$=18.4mol/L,
故选D.
点评 本题考查物质的量浓度计算,为高频考点,明确各个物理量的关系是解本题关键,侧重考查学生分析计算能力,注意:溶液体积不等于水体积与氨气体积之和,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定是氧化还原反应 | |
| B. | 有单质参加的反应一定是氧化还原反应 | |
| C. | 分解反应可能是氧化还原反应 | |
| D. | 凡是氧化还原反应都不可能是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据维生素的溶解性可以将维生素分为脂溶性和水溶性两大类 | |
| B. | 人体需要的维生素都必须从食物中摄取 | |
| C. | 维生素C具有较强的还原能力,容易被还原 | |
| D. | 维生素的作用是维持细胞的正常功能、调节人体新陈代谢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
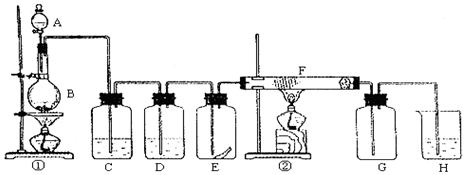
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 实验室用自来水制备蒸馏水 | 将自来水倒入烧杯中,小心给烧杯加热 |
| B | 配制一定浓度的氯化钾溶液100mL | 将称好的氯化钾固体放入100mL容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 检验溶液中是否含SO42- | 先加入稀盐酸,无明显现象,再加入BaCl2溶液 |
| D | 取出分液漏斗中的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | Li、Na、K的原子半径和密度随原子序数的增加而增大 | |
| D. | C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com