
����Ŀ��������ͭ�Ǻϳ��������������в�������������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
����������
![]() +Cu��OH��2����
+Cu��OH��2����![]() ��2Cu+H2O
��2Cu+H2O
�Ʊ��������װ��ʾ��ͼ��ͼ�����Ⱥͼг�װ�õ�������
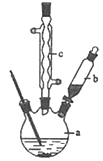
��֪����������۵�Ϊ76.5����������ˮ�������Ҵ���
�ش��������⣺
��1����250mL����ƿa�м���70mL 70%���ᣮ���ƴ�����ʱ����������ˮ��Ũ������Ⱥ�˳���� ��
��2����a�е���Һ������100���������μ�40g�����浽������Һ�У�Ȼ��������130��������Ӧ����װ���У�����b�������� ������c�������� ���������� ����Ӧ�������������ˮ���ٷ�����������Ʒ��������ˮ��Ŀ���� �����������п����ڷ��뱽�����Ʒ���� ��������
A����Һ©��
B��©��
C���ձ�
D��ֱ��������
E��������
��3���ᴿ������ķ������ؽᾧ�����յõ�44g��Ʒ��������IJ����� �����ٷ�����
��4������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ��������� ��
���𰸡���1���ȼ�ˮ���ټ���Ũ���ᣮ
��2���μӱ����棻������������������������������������ʹ�����ķ�ӦҺ������
���ڱ�����������BCE
��3��94.6%����95%����
��4�����������ܽ�ȣ����ڳ�ַ�Ӧ
��������
�����������1��ϡ��Ũ����ų��������ȣ����ƴ�����ʱ��Ӧ���ܶȴ��ע���ܶ�С��Һ���У���ֹ���ʱ�ų���ʹҺ�ηɽ������������ˮ��Ũ������Ⱥ�˳�����ȼ�ˮ���ټ���Ũ���ᣬ�ʴ�Ϊ���ȼ�ˮ���ټ���Ũ���
��2����ͼ��֪��cΪ���������ܣ�������Ϊ��������ʹ�����ķ�ӦҺ������������b������Ϊ�μӱ����棻���뱽�����Ʒ�����ù��˲���������Ҫ������Ϊ©�����ձ�������������ѡBCE���ʴ�Ϊ���μӱ����棻���������ܣ���������ʹ�����ķ�ӦҺ��������BCE��
��3���ɷ�Ӧ![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4��֪��40g���������ɱ�����Ϊ40g��
+NH4HSO4��֪��40g���������ɱ�����Ϊ40g��![]() =46.5g�����յõ�44g��Ʒ��������IJ�����
=46.5g�����յõ�44g��Ʒ��������IJ�����![]() ��100%=95%���ʴ�Ϊ��95%��
��100%=95%���ʴ�Ϊ��95%��
��4��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�Ȼ����Cu��OH��2��Ӧ��ȥ�����ᣬ������ܼ����Ҵ������������������ܽ�ȣ����ڳ�ַ�Ӧ���ʴ�Ϊ�����������ܽ�ȣ����ڳ�ַ�Ӧ��


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º����ܱ������У��ܹ�������ӦA��s����3B��g��![]() 2C��g����D��g���Ѵ�ƽ������� ��
2C��g����D��g���Ѵ�ƽ������� ��
����������ѹǿ���䣻
�����������ܶȲ��䣻
��B�����ʵ���Ũ�Ȳ��䣻
��������B��C��D���������Ũ�ȱ�Ϊ3:2:1��
������������Է����������䣻
������3molB��ͬʱ����2molC
A���٢ڢ� B���ڢۢ� C���ڢۢ� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ�л�������A����C��H��OԪ�أ���A��صķ�Ӧ��ͼ���£�
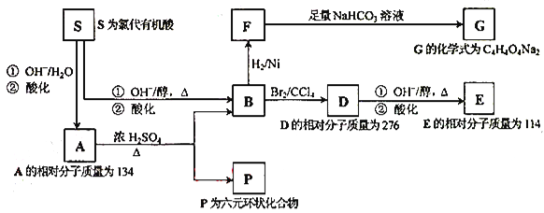
��1��д��A��P��E��S�Ľṹ��ʽ
A�� ��P�� ��E�� ��S�� ��
��2��д����ŨH2SO4���ڲ����ȵ������£�F�������Ҵ���Ӧ�Ļ�ѧ����ʽ��
��
��3��д����D������ͬ�����ŵ�D������ͬ���칹��Ľṹ��ʽ��
��
��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ˮ�Dz���������������Ϊ�˼���Cl���Ĵ��������ѡ�����������е� �� ��
A��ʯ����Һ B�����Ȼ�̼ C������������Һ D����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϲ��ð��Ĵ������Ʊ����ᣬ��Ӧ���£�
![]()
![]()
��������������������Ϊ0.20���������������Ϊ0.80
��1��ΪʹNH3ǡ����ȫ����ΪNO����-����������а����������Ϊ ����С����ʾ������2λС����
��2��1mol NH3��ȫת��HNO3�����ڴ˹����в�����ˮ��������HNO3��Һ����������Ϊ ����С����ʾ������2λС����
��3����֪NH3��ȫת��NO��ת����Ϊ95%����NOת��HNO3��ת����Ϊ92%.�������17��NH3����ȡ��������Ϊ0.63��������ҺΪ ��
��4�����Ṥҵ�����е�β�����ô�����Һ���գ��йصĻ�ѧ��ӦΪ��
![]() ��
��
![]() ��
��
��ÿ����1mol CO2��������Һ����������40g����������Һ��NaNO2��NaNO3���ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��E����ѧ������5�ֻ����A��B�����������֮���ת����ϵ��ͼ��ʾ��
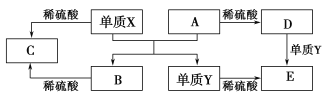
������˵����ȷ�� ��
A������X��A��Ӧ�Ļ�ѧ����ʽ��Al2O3��2Fe![]() Fe2O3��2Al
Fe2O3��2Al
B������D��Һ�н��������ӵķ�Ӧ��Fe3����3SCN��===Fe(SCN)3��
C������X�͵���Y��һ�������¾�����ˮ�����û���Ӧ
D�����ڻ�����B��C���������ᷴӦ��������Ӧ���������߾������Ի�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������SO2��NOx���γ����ꡢ��Ⱦ����������NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ش��������⣺
��1�� NaClO2�Ļ�ѧ����Ϊ____________��
��2���ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ ������ѹǿ��NO��ת����________________�����������������������������������
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��___________��������������������������С������
����ʵ������֪������Ӧ����___________������Ӧ���ʣ���������������С��������ԭ���dz���SO2��NO�������еij�ʼŨ�Ȳ�ͬ����������___________��
��3����ͬ�¶��£�NaClO2��Һ����������Ӧ�У�SO2��NO��ƽ���ѹPe��ͼ��ʾ��
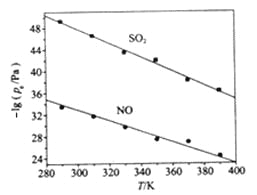
����ͼ������֪����Ӧ�¶����ߣ�����������Ӧ��ƽ�ⳣ����____________����������������������������С������
����ӦClO2+2SO32===2SO42+Cl��ƽ�ⳣ��K����ʽΪ___________��
��4���������NaClO��Ca(ClO)2���NaClO2��Ҳ�ܵõ��Ϻõ���������Ч����
���ӻ�ѧƽ��ԭ��������Ca(ClO)2���NaClO���е��ŵ���_______��
����֪���з�Ӧ��
SO2(g)+2OH(aq)===SO32(aq)+H2O(l) ��H1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq) ��H2
CaSO4(s)===Ca2+(aq)+SO42(aq) ��H3
��ӦSO2(g)+ Ca2+��aq��+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)����H= _��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�������ڱ��е����λ�������ʾ����������������Ӧˮ������ǿ��ˮ�ԣ��Ͷ���ͬһ���ڣ���ԭ������������ڲ������ͬ�������������ж���ȷ���ǣ� ��
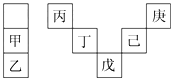
A. ������������������ཫ̫����ת��Ϊ���ܵij��ò���
B. ��̬�⻯����ȶ��ԣ�����������
C. �����£����ҵĵ��ʾ�����ˮ���ҷ�Ӧ
D. �������ԭ���������28
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���Ƕ�����Ԫ�أ���ԭ��������������A��Bͬ���ڣ�A��Dͬ���壬Aԭ���������������ڲ�������Ķ�����BԪ������������������������B����������C�������ӵ��Ӳ�ṹ��ͬ��C�ĵ�����B�ĵ����ڲ�ͬ�����·�Ӧ��������C2B��C2B2��E������������ԭ�Ӱ뾶��С��Ԫ�ء���ش�
��1��D��Ԫ�����ڱ��е�λ���� ��
��2��C2B�ĵ���ʽ�� ��AB2�Ľṹʽ�� ��
��3��B��C��E�����Ӱ뾶�ɴ�С��˳��Ϊ ���û�ѧʽ�ش���ͬ����A��D��EԪ������������Ӧˮ�����������ǿ����Ϊ ��
��4��B����̬�⻯����H2S��ȷе�ߵ��� ���û�ѧʽ�ش𣩣�ԭ���� ��
��5��ˮ���̺������꣬����ʹ��ߺ�����Ⱦɫ��ʹˮ������ζ��EB2����������ȥˮ�г����Mn2+�����ɺ�ɫ����MnO2��������13.50gEB2ʱ����ת����1mol���ӣ���Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com