
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最低化合价 +2 +1 +5 +7 +1 +5 +3
﹣2 ﹣3 ﹣1 ﹣3
下列说法正确的是()
A. 原子序数④元素大于⑦元素
B. ②、③处于同一周期
C. 上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D. ⑧号元素原子结构示意图为:
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: 电子层越多,半径越大,同周期从左向右原子半径在减小,最高正价在增大,最高正价等于族序数,由短周期元素的数据可知:
①只有﹣2价,处于第ⅥA族;①为O;⑤有+7、﹣1价,①为Cl;③⑥最高正价为+1,处于第ⅠA族,原子半径大于其它原子,且⑥的原子半径较大,故③为Li,⑥为Na;④⑦有+5、﹣3价,处于ⅤA族,④的原子半径较大,故④为P、⑦为N;②最高正价为+2,处于ⅡA族,原子半径大于Li,故②为Mg;⑧最高正价为+3,处于ⅢA族,原子半径比Cl小,故⑧为B,并结合元素周期律、化合物的性质来解答.
解答: 解:电子层越多,半径越大,同周期从左向右原子半径在减小,最高正价在增大,最高正价等于族序数,由短周期元素的数据可知:
①只有﹣2价,处于第ⅥA族;①为O;⑤有+7、﹣1价,①为Cl;③⑥最高正价为+1,处于第ⅠA族,原子半径大于其它原子,且⑥的原子半径较大,故③为Li,⑥为Na;④⑦有+5、﹣3价,处于ⅤA族,④的原子半径较大,故④为P、⑦为N;②最高正价为+2,处于ⅡA族,原子半径大于Li,故②为Mg;⑧最高正价为+3,处于ⅢA族,原子半径比Cl小,故⑧为B,
A.④⑦同主族,④的原子半径大,则④原子序数大,故A正确;
B.②为Mg,③为Li,则②、③号元素不处于同一周期,故B错误;
C.⑤为Cl,最高价氧化物的水化物为HClO4,是含氧酸中酸性最强的酸,故C正确;
D.⑧为B,原子结构示意图为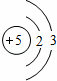 ,故D错误;
,故D错误;
故选AC.
点评: 本题考查原子结构与元素周期律,题目难度中等,熟悉原子半径、化合价的变化规律是解答本题的关键,⑧为学生解答的易错点.


科目:高中化学 来源: 题型:
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数,则下列叙述正确的是()
A. 所得溶液的物质的量浓度:c=1mol•L﹣1
B. 所得溶液中含有NA个HCl分子
C. 36.5g HCl气体在标准状况下占有的体积约为22.4L
D. 所得溶液的质量分数:w=36.5
查看答案和解析>>
科目:高中化学 来源: 题型:
以下最接近阿伏伽德罗常数的是()
A. 2.0L 1.Omol•L﹣1 CH3COOH溶液中的H+离子数
B. 2.0L 1.0 mol•L﹣1CH3COONa溶液中的CH3COO﹣离子数
C. 1.0L 1.0 mol•L﹣1NaHCO3溶液中的HCO 离子数
离子数
D. 1.0L 1.0 mol•L﹣1Na2CO3 溶液中的 C032﹣离子数
查看答案和解析>>
科目:高中化学 来源: 题型:
能在水溶液中大量共存的一组离子是()
A. H+、Fe2+、NO3﹣、SiO32﹣ B. Ag+、Fe3+、Cl﹣、SO42﹣
C. K+、SO42﹣、Cu2+、NO3﹣ D. NH4+、OH﹣、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2几乎能与所有常见的气态非金属氧化物在一定条件下反应,如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:, .
(2)通过比较可知,当非金属元素处于 价态时,与Na2O2反应有O2生成.
(3)等物质的量的N2、O2、CO2的混合气体通过Na2O2后,体积变为原体积的 (同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
(同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a﹣b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有()
A. 能与水反应 B. 能与氢氧化钠反应
C. 能与硫酸反应 D. 不能与碳酸钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为l mol•L﹣1
B. 将100 mL 2 mol•L﹣1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol•L﹣1
C. 将l0 mL l.0mol•L﹣1NaCl溶液与90mL水混合,所得溶液的浓度为0.1 mol•L﹣1
D. 将10 g CaO加入100 mL饱和石灰水中,充分搅拌、静置并恢复到原来的温度,所得溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为:漂粉精固体 和浓盐酸,相关的化学反应方程式为: .
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
a b c d
Ⅰ 干燥的有色布条 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 硅胶 浓硫酸 无水氯化钙
Ⅲ 湿润的有色布条 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .该现象 (填“能”或“不能”)说明溴的非金属性强于碘,原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,物质的量最大的是A,含分子个数最多的是A,含原子个数最多的是E,质量最大的是D.
A.6g H2; B.0.5mol CO2; C.1.20×1024个HCl分子; D.148g H2SO4;
E.92g乙醇(C2H5OH); F.4℃时10mL水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com