
分析 氧化还原反应的实质是电子转移,有化合价变化的反应是氧化还原反应,在氧化后还原反应中,化合价升高元素失电子,被氧化,发生氧化反应,含有该元素的反应物是还原剂,化合价降低元素得到电子,被还原发生还原反应,含有该元素的反应物是氧化剂,以此解答.
解答 解:在化学反应中,如果反应前后元素化合价发生变化,就一定有电子转移,这类反应就属于氧化还原反应,元素化合价升高,表明该元素原子失去电子,含该元素的物质发生氧化反应,这种物质是还原剂;元素化合价降低,表明该元素原子得到电子,含该元素原子的物质发生还原反应,这种物质是氧化剂.
故答案为:电子;氧化还原;失去;氧化;还原剂;得到;还原.
点评 本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及化学用语的使用为解答的关键,侧重基础知识和分析应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 反应2NO2(g)?N2O4(g)△H<O,升高温度该反应平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
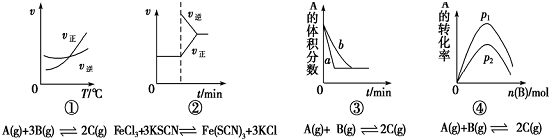
| A. | 图①是其他条件一定时反应速率随温度变化的图象,图象表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移 | |
| B. | 图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化 | |
| C. | 图③可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响 | |
| D. | 图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
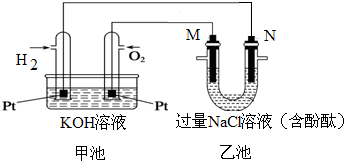 如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:
如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 括号内为杂项 | 除杂试剂 | 除杂操作 | |
| A | Na2O2(Na2O) | O2 | 在纯氧中加热 |
| B | Na2CO3(NaHCO3) | CO2 | 通入过量的CO2 |
| C | FeCl(FeCl2) | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4) | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
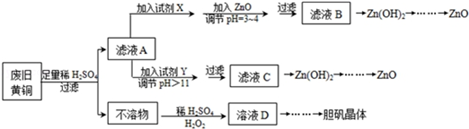
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com