
| A、NaCl |
| B、CH3COONa |
| C、FeCl3 |
| D、CH3COONH4 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
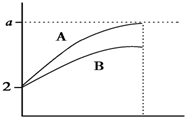 pH=2的两种酸溶液A、B各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的两种酸溶液A、B各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A、稀释过程中,c(H+)不断减少、c(OH-)不断增多 |
| B、稀释后,A酸溶液的酸性比B酸溶液弱 |
| C、若a=4,则A是强酸,B是弱酸 |
| D、A、B两种酸溶液的物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、途径I和途径Ⅱ所得混合气体的百分组成相同 |
| B、途径I所得C物质的浓度为途径Ⅱ所得C物质浓度的一半 |
| C、途径I的反应速率υ(A)与途径Ⅱ的反应速率υ(C)相等 |
| D、途径I所得混合气体的密度为途径Ⅱ所得混合气体的密度的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.86g硫酸铜,放入500mL的容量瓶中,配成480mL溶液 |
| B、称取12.0g胆矾(CuSO4?5H2O),溶于500mL水中 |
| C、称取8.0g硫酸铜,配成500mL溶液 |
| D、称取12.5g胆矾(CuSO4?5H2O),溶于500mL水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1min内的平均速率为v(H2)=
| ||
| B、若温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | ||
| C、保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到平衡时CO转化率增大,H2O的体积分数减小 | ||
| D、保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳与氯气制漂白粉:2OH-+Cl2=ClO-+Cl-+H2O |
| B、铁与稀硫酸制氢气:Fe+6H+=2Fe3++3H2↑ |
| C、Ba(OH)2溶液中滴加过量NaHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |
| D、向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡逆向移动 |
| B、平衡时A的体积分数增大 |
| C、平衡时C的体积分数增大 |
| D、平衡时各气体的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com