
| A. | 确定过程是否一定会发生 | B. | 判断过程的方向 | ||
| C. | 判断过程发生的速率 | D. | 判断过程的热效应和熵变 |
科目:高中化学 来源: 题型:填空题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
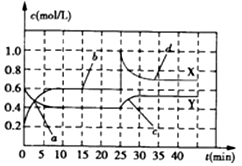
| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com