
【题目】摩尔是表示
A.物质的量的单位B.物质的质量的单位
C.温度的单位D.物质的体积的单位
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】甲基呋喃与氨在高温下反应得到甲基吡咯:
 +H2O
+H2O
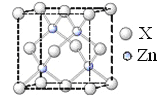
(1)Zn的基态原子核外电子排布式为____________。
(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是_____________(填元素符号)。
(3)1 mol甲基呋喃分子中含有σ键的数目为_______________mol。
(4)甲基吡咯分子中碳原子轨道的杂化轨道类型是____________。与NH3分子互为等电子体的阳离子为________________。
(5)甲基吡咯的熔沸点高于甲基呋喃的原因是________________。
(6)锌的某种化合物晶胞结构如图所示,则构成该化合物的两种粒子个数比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,分别向密闭容器内可移动活塞的两边充入空气,H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为

A.2∶7 B.5∶4 C.2∶1 D.7∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( ) 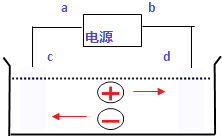
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
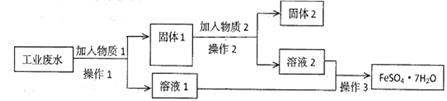
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是
A.CaCl2 = Ca2++2Cl-B.Na2SO4 = Na22++SO42-
C.HNO3 == H++NO3-D.NaOH = Na++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是

选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取Na2S2O3·5H2O的装置图(略去部分夹持仪器)。
已知:Na2SO3 +S![]() Na2S2O3
Na2S2O3
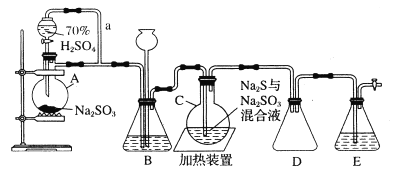
按要求回答下列问题:
(1)仪器A的名称是___________________。
(2)分液漏斗中用70%较浓硫酸的理由是___________________。
(3)装置C中生成S的离子反应方程式是___________________。
(4)E是SO2的尾气处理装置,则装置D的作用是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com