
分析 先根据物质的量与其它物理量之间的转化关系,将选项中的各量转化成物质的量,根据N=n×NA可知物质的量越大,含有的分子数越多,原子的物质的量越大,含有的原子数越多,再根据m=n×M进行计算.
解答 解:①6gH2的物质的量为:$\frac{6g}{2g/mol}$=3mol,n(H原子)=3×2=6mol,m=6g;
②0.5molNH3的物质的量为:0.5mol,n(H原子)=0.5×3=1.5mol,m=0.5mol×17g/mol=8.5g,
③1.204×1024个HCl的物质的量为:2mol,n(H原子)=2×1=2mol,m=2mol×36.5g/mol=73g,
④147gH2SO4的物质的量为:$\frac{147g}{98g/mol}$=1.5mol,n(H原子)=1.5×2=3mol,m=147g,
⑤标准状况下44.8L的CH4的物质的量为:$\frac{44.8L}{22.4L/mol}$=2mol,n(H原子)=2×4=8mol,m=2mol×16g/mol=32g;
因此:物质的量最大的是①,故含有分子数最多的就是①,H原子的物质的量最大的是⑤,故含有H原子数最多的就是⑤,质量最大的是④,
故答案为:①;①;⑤;④.
点评 本题考查物质的量有关计算、微粒数目计算、阿伏伽德罗定律及其推论,明确基本公式是解本题关键,注意根据PV=nRT理解阿伏伽德罗定律及其推论,题目难度不大..


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
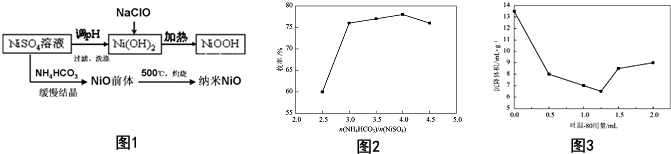
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | BaCl2与Na2SO4溶液 | Ba(OH)2与H2SO4溶液 |
| B | 石灰石与硝酸反应 | 生石灰与盐酸 |
| C | 氢氧化钠与盐酸 | 氢氧化钠与硫酸氢钠 |
| D | Na2CO3溶液与硝酸溶液 | CaCO3与硝酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51% | B. | 56% | C. | 57% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 反应Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,向甲试管中滴加5ml 0.05mol/L的Na2S2O3和5ml 0.02mol/LH2SO4,乙试管中滴加10ml 0.05mol/L的Na2S2O3和10ml 0.02mol/LH2SO4 | 探究浓度对化学平衡的影响 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com