
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O===FeCl3·6H2O。

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
①接_______________________________________________________
(2)烧瓶A发生的反应中,氧化剂是________(填物质名称),B中反应的化学方程式是___________________。
(3)容器D的作用是_____________________________________________,容器E的作用是__________________________________________________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是___________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整,还须补充________装置(若第一问填“是”,则此问不需要作答)。
【答案】⑦ ⑥ ④ ⑤ ② 二氧化锰 3Cl2+2Fe![]() 2FeCl3 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
2FeCl3 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
【解析】
(1)根据实验原理和目的及各装置的作用决定仪器组装顺序;
(2)二氧化锰固体和浓盐酸反应制备氯气;铁和氯气反应生成氯化铁;
(3)容器D中装有浓硫酸,浓硫酸具有吸水性,起干燥作用;容器E中是饱和的氯化钠溶液,能除去氯气中的氯化氢;
(4)A处是制取氯气,B处是氯气和铁反应,所以先点燃A,使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;
(5)氯气有毒,不能任意排放到空气中,应该用尾气处理装置。
(1)A 装置制备氯气,气体分别通入E盛有饱和氯化钠溶液的洗气瓶除去氯气中的氯化氢、D盛有浓硫酸的洗气瓶除去氯气中的水蒸气,除杂干燥后和B装置中的铁反应,装置C防止空气中的水蒸气进入,按照气体流向从左到右顺序连接仪器应是为:⑦⑥④⑤②;
(2)二氧化锰固体和浓盐酸反应制备氯气,氧化剂是二氧化锰;铁和氯气反应生成氯化铁 3Cl2+2Fe![]() 2FeCl3 ;
2FeCl3 ;
(3)容器D中装有浓硫酸,浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气;容器E中是饱和的氯化钠溶液,氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O![]() H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,用饱和食盐水除去氯气中混有的氯化氢气体。
H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,用饱和食盐水除去氯气中混有的氯化氢气体。
(4)A处是制取氯气,B处是氯气和铁反应,所以先点燃A,使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;
(5)氯气有毒,污染环境,这套实验装置不完整,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠,补充:装有氢氧化钠溶液的烧杯(或尾气吸收)


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护、资源利用等密切相关,下列说法正确的是
A. 大米、玉米、小麦中的淀粉经水解可变成乙醇
B. 利用二氧化碳制造全降解塑料,可以缓解温室效应
C. 测定氢氧化钠的熔点时,可以将氢氧化钠固体放入石英坩埚中高温加热
D. 海洋中含有丰富的矿产资源,仅利用物理方法可以获得![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入1molCH3COOCH3(l)和1molC6H13OH(l)发生反应:CH3COOCH3(l)+C6H13OH(l) ![]() CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。
CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。

回答下列问题:
(1)CH3COOCH3的一种同分异构体属于酸,它的结构简式为___。
(2)己醇(C6H13OH)中,含3个甲基的结构有___种(不考虑立体异构)。
(3)M点:正反应速率___逆反应速率(填“大于”“小于”或“等于”,下同)。N点正反应速率___M点逆反应速率。
(4)上述反应在0~5min内CH3COOCH3的平均反应速率为___mol·min-1。
(5)上述反应达到平衡时,C6H13OH的转化率为___%。
(6)N点混合物中CH3COOC6H13的物质的量分数为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用浓H2SO4配制480mL 0.2mol·L-1的稀H2SO4。
(1)需要量取98%密度为1.84g·cm-3的浓硫酸________mL。
(2)配制时,必须使用的仪器有______(填代号),还缺少的仪器是_________、_________。
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是________________、_______________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”、“无影响”)。
①容量瓶没有干燥________,
②用量筒量取98%的硫酸溶液时俯视________,
③溶液转移到容量瓶后,未进行洗涤操作_________ ,
④定容时俯视容量瓶__________,
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和砷均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为________。同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为________________。
(2)Na3AsO3中所含阴离子的立体构型为___________,写出一个与AsO33-具有相同空间构型和键合形式的分子____________________(填化学式)。
(3)在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为__________,_________;1mol尿素分子中,![]() 键的数目为___________。
键的数目为___________。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是__________________。
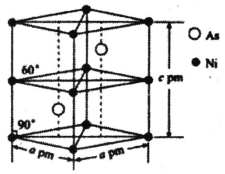
(5)某砷镍合金的晶胞结构如图所示,阿伏加德罗常数的值为NA,则该晶体的密度![]() =________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
=________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HC1溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________。
(3)停止加热后的操作是____________________________________,再将管6和管7拆下。
(4)查阅文献资料知道,将NaC1O溶液加热,NaC1O分解可生成NaC1O3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17

第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一只试管中。
(5)已知![]() ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(![]() )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________,证实C1-存在。反应的离子方程式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体2 mL(同温同压下),则原混合气体中氧气的体积是( )
A.1.3 mLB.2.4 mLC.3 mLD.4 mL或1.2 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )

A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com