
 -NH2中-NH2上的氢原子较活泼.
-NH2中-NH2上的氢原子较活泼. .
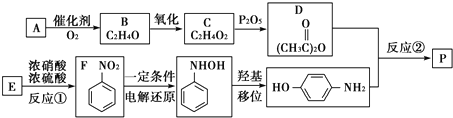
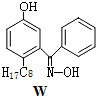
. ,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号).
,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号). 、
、 、
、 .
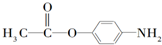
. 分析 A发生催化氧化生成B,则A中含有2个C原子、4个H原子,A分子的核磁共振氢谱只有一个吸收峰且能使溴水褪色,则A结构简式为CH2═CH2,B能发生氧化反应生成C,C反应生成D,根据D结构简式知,B结构简式为CH3CHO、C结构简式为CH3COOH,D是乙酸酐;E发生取代反应生成F,则E结构简式为 ,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为
,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A发生催化氧化生成B,则A中含有2个C原子、4个H原子,A分子的核磁共振氢谱只有一个吸收峰且能使溴水褪色,则A结构简式为CH2═CH2,B能发生氧化反应生成C,C反应生成D,根据D结构简式知,B结构简式为CH3CHO、C结构简式为CH3COOH,D是乙酸酐;E发生取代反应生成F,则E结构简式为 ,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为
,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为 ,
,
(1)通过以上分析知,A结构简式为CH2═CH2,故答案为:CH2═CH2;
(2)C发生取代反应生成D,结构简式为2CH3COOH→(CH3CO)2O+H2O,故答案为:2CH3COOH→(CH3CO)2O+H2O;
(3)反应②的反应类型为是取代反应,P结构简式为 ,P在碱性条件下反应方程式为
,P在碱性条件下反应方程式为 ,
,
故答案为:取代反应; ;
;
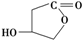
(4)W的结构简式为 ,W的酸性水解产物结构简式为HOOCCH2CH(OH)CH2OH,其名称是3,4-二羟基丁酸,
,W的酸性水解产物结构简式为HOOCCH2CH(OH)CH2OH,其名称是3,4-二羟基丁酸,
A.含有醇羟基,所以与浓HBr溶液反应生成溴代产物,故不选;
B.含有酯基,所以发生水解反应,故不选;
C.苯环碳碳不饱和键,所以不能与溴的CCl4溶液发生加成反应,故选;
D.含有醇羟基且连接醇羟基碳原子相邻碳原子上含有氢原子,所以能发生消去反应,故不选;
E.醇羟基能发生催化氧化生成羰基,所以能催化氧化生成含羰基的化合物,故不选;
故答案为:3,4-二羟基丁酸;C;
(5)P为 ,P的同分异构体较多,其中一类与F互为同系物且氮原子与苯环直接相连,说明含有苯环且含有硝基,如果含有乙基,则有邻间对三种结构;
,P的同分异构体较多,其中一类与F互为同系物且氮原子与苯环直接相连,说明含有苯环且含有硝基,如果含有乙基,则有邻间对三种结构;
如果含有两个甲基,如果两个甲基处于邻位,有两种结构;
如果两个甲基处于间位,有三种结构;
如果两个甲基处于对位,有一种结构;所以符合条件的有3+2+1+3=9种;
另一类同分异构体同时符合下列条件:
①属于对位二取代苯且苯环上连接-NH2;
②能发生水解,说明含有酯基,
符合条件的结构简式有 、
、 、
、 ,
,
故答案为:9; 、
、 、
、 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物反应类型、反应条件及断键和成键方式是解本题关键,难点是限制型同分异构体种类判断,题目难度中等.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
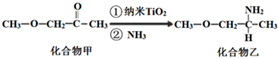
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
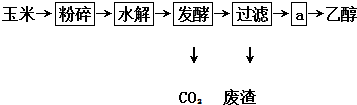
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
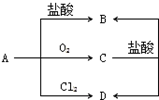 已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:
已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
. .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
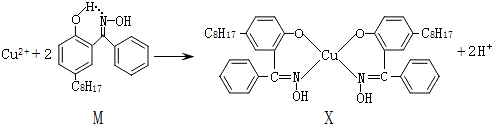
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH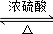 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 影响化学反应速率的因素与化学物质本身无关 | |
| B. | 反应物颗粒越小,其表面积就越小,化学反应速率就越慢 | |
| C. | 加入催化剂一定能够加快化学反应速率 | |
| D. | 增大反应物的浓度和升高反应物的温度都可以加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com