
| 元素 | A | B | C | D |
| 性质 或结 构信息 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
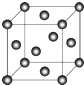 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化). 分析 A原子核外有两个电子层,最外层有3个未成对的电子,外围电子排布为2s22p3,故A为N元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,故B为S元素;C原子的核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价,故C为Cu元素;D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,故D为C元素,据此解答.
解答 解:A原子核外有两个电子层,最外层有3个未成对的电子,外围电子排布为2s22p3,故A为N元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,故B为S元素;C原子的核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价,故C为Cu元素;D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,故D为C元素.
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(2)B元素的低价氧化物分子为SO2,S原子孤电子对数为$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,杂化轨道数目为3,故S原子采取sp2杂化,B元素的最高价氧化物为SO3,分子中S原子价层电子对数为3+$\frac{6-2×3}{2}$=3,其的VSEPR构型为平面三角形,B元素与D元素形成分子为CO、CO2,空间构型为,直线形,
故答案为:sp2杂化;平面三角形;直线形;
(3)D元素最高价氧化物为二氧化碳,同主族相邻元素最高价氧化物为二氧化硅,CO2是分子晶体,SiO2是原子晶体,则二氧化碳的熔点比二氧化硅的低,
故答案为:低;CO2是分子晶体,SiO2是原子晶体;
(4)C元素的硫酸盐为硫酸铜,硫酸铜溶液中逐滴加入过量氨水溶液,先生成氢氧化铜沉淀,后氢氧化铜溶解得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液,后一现象的离子方程式为:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-,
故答案为:先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-;
(5)Cu晶体为面心立方密堆积,以顶点Cu原子研究,与之相邻的Cu原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,则Cu原子配位数为$\frac{3×8}{2}$=12,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{64}{{N}_{A}}$g,则晶胞密度为4×$\frac{64}{{N}_{A}}$g÷(a cm)3=$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3,
故答案为:12;$\frac{4×64}{{a}^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶体类型与性质、配合物、晶胞计算等,注意同周期第一电离能异常情况,掌握熔沸点高低比较方法.


科目:高中化学 来源: 题型:选择题
| A. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$ 3O2 | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| C. | 3C12+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
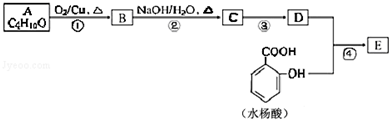
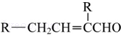 ;
;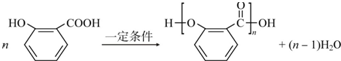 .
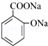
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | RaCl2的熔点比CaCl2高 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素属于无机化合物 | |
| B. | 青蒿素属于氧化物 | |
| C. | 标准状况下,1mol青蒿素的体积约为22.4L | |
| D. | 青蒿素的摩尔质量为282g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
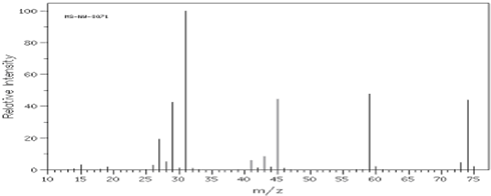
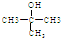 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
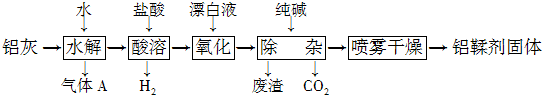
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com