
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
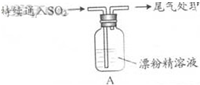 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
分析 (1)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(2)pH试纸变蓝色,说明溶液呈碱性,次氯酸具有漂白性;
(3)①氯气能使湿润的淀粉碘化钾试纸变蓝色;
②SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)根据其它酸是否溶液变为黄绿色;
(5)①SO2被氧化为SO42-,硫酸根离子和钙离子结合生成微溶物硫酸钙;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸,据此书写.
解答 解:(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明又具有漂白性,故答案为:碱性、漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否含有Cl2,排除Cl2干扰,故答案为:检验白雾中是否含有Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,硫酸与AgNO3溶液反应产生硫酸银白色沉淀,故SO2可以使酸化的AgNO3溶液产生白色沉淀,
故答案为:白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色,故答案为:向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4,故答案为:CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸,反应方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
点评 本题考查探究实验,根据实验现象分析物质的性质,同时考查学生分析问题、总结问题能力,注意:不能用pH试纸测定氯水pH值,次氯酸有漂白性导致测定不准确,为易错点.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Fe2+、Cu2+、AlO2-、ClO- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.
如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
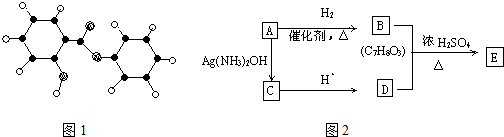

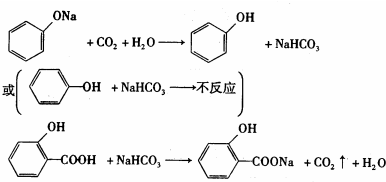 .
.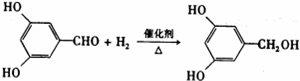 ;反应类型:加成反应.
;反应类型:加成反应.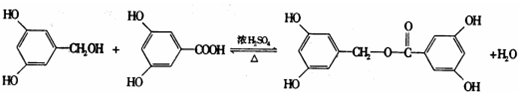 ;反应类型:酯化反应
;反应类型:酯化反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| D. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的,测定值偏小 | |
| B. | 用量筒量取10mLNaOH 溶液时,俯视刻度.量出的体积大于10mL | |
| C. | 使用天平称量时不小心将药品与砝码的位置放反了,称最结果可能是准确的 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com