
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
分析 (1)该反应是一个反应前后气体体积增大的吸热反应,升高温度、减小压强、减少生成物的量都能使平衡向正反应方向移动;
(2)利用盖斯定律构造目标热化学方程式,反应热也进行相应的运算;
(3)①正反应放热,降温时平衡正向移动;
②平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$;
③反应前后气体体积不变,等比例加入反应物,平衡与原平衡等效.
解答 解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误;
B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;
(2)已知:①C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ•mol-1,
②C(s)+CO2(g)?2CO(g),△H=+172.5kJ•mol-1
根据盖斯定律,①-②得:CO(g)+H2O(g)?CO2(g)+H2(g),△H=131.3kJ•mol-1-172.5kJ•mol-1=-41.2kJ•mol-1,
故答案为:-41.2kJ•mol-1;
(3)①正反应放热,降温时平衡正向移动,v(正)>v(逆),
故答案为:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$=$\frac{0.03×0.03}{0.05×0.05}$=$\frac{9}{25}$,
故答案为:$\frac{9}{25}$;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,
故答案为:不变.
点评 本题主要考查了平衡移动、盖斯定律应用、平衡常数的计算、等效平衡,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元 素 特 征 信 息 |
| A | 最外层电子数是次外层电子数的2倍 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.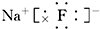 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂既可以是天然物质,也可以是人工合成物质,两者使用时都要控制用量 | |
| B. | 形成酸雨的元凶主要有NOx、SO2、CO2等 | |
| C. | 人体的血脂高,是因为血液中含有的名为“血脂”的化学物质超标 | |
| D. | 我国古代化学即对人类做出了重大贡献,其中冶铁和炼钢就是其中之一,前者得到的是混合物,后者是将前者提纯得到纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 如果反应开始时加入2molN2和6molH2,则达到平衡时,n(N2):n(H2)=1:3 | |
| C. | 达到化学反应限度时,生成2mol NH3 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
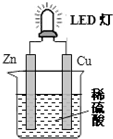
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com