
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知; CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
H2(g)+ ![]() O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。
CH3OH的燃烧热△H=_______。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:
CO2(g)+CH4(g)![]() CH3COOH(g) △H=+36.0 kJ/mol
CH3COOH(g) △H=+36.0 kJ/mol
在不同温度下乙酸的生成速率变化如右图所示。

①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是______,当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是________。
②欲使乙酸的平衡产率提高,应采取的措施是________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应: C(s)+CO2(g)![]() 2CO(g)。
2CO(g)。
①向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示。则该反应为_____(填“放热”或“吸热”)反应,某温度下,若向该平衡体系中再通入0.2molCO2,平衡____(填“正向”“逆向”“不”)移动,达到新平衡后,体系中CO的百分含量________ (填“变大”“变小”“不变”)。

②向压强为p体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________(用含p的代数式表示),若向平衡体系中再充入V(CO2): V(CO)=5:4的混合气体,平衡______(填“正向”“逆向”“不”)移动。
【答案】 726.4kJ/mol 催化剂活性降低 温度 A C 吸热 正向 变小 25% ![]() (或0.267p) 逆向
(或0.267p) 逆向
【解析】(1)已知:①CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)△H=-131.0kJ/mol,②H2(g)+
CH3OH(l)+H2O(l)△H=-131.0kJ/mol,②H2(g)+ ![]() O2(g)= H2O(l) △H=-285.8kJ/mol。根据盖斯定律,将②×3-①得:CH3OH(l)+
O2(g)= H2O(l) △H=-285.8kJ/mol。根据盖斯定律,将②×3-①得:CH3OH(l)+ ![]() O2(g)→2H2O(l)+ CO2(g) △H=(-285.8kJ/mol)×3-(-131.0kJ/mol)= 726.4kJ/mol,CH3OH的燃烧热△H=726.4kJ/mol,故答案为:726.4kJ/mol;
O2(g)→2H2O(l)+ CO2(g) △H=(-285.8kJ/mol)×3-(-131.0kJ/mol)= 726.4kJ/mol,CH3OH的燃烧热△H=726.4kJ/mol,故答案为:726.4kJ/mol;
(2)①催化剂的活性与温度有关,当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是催化剂活性降低,温度越高,反应速率越快,当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是温度,故答案为:催化剂活性降低;温度;
②欲使乙酸的平衡产率提高,应该使平衡正向移动。A.正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高,正确;B. 正反应为吸热反应,降低温度,平衡逆向移动,乙酸的平衡产率降低,错误;C.增大压强,平衡正向移动,乙酸的平衡产率提高,正确;D.降低压强,平衡逆向移动,乙酸的平衡产率降低,错误;故选AC;
(3)①随着温度的升高,CO2的物质的量浓度逐渐减小,说明平衡正向移动,因此该反应属于吸热反应,某温度下,若向该平衡体系中再通入0.2molCO2,平衡正向移动,充入二氧化碳后,相当于增大压强,平衡向逆反应方向进行,达到新平衡后,体系中CO的百分含量减小,故答案为:吸热;正向;变小;
②设充入的二氧化碳的物质的量为x,反应的二氧化碳为y,根据C(s)+CO2(g)![]() 2CO(g),有
2CO(g),有![]() ×100%=40.0%,则
×100%=40.0%,则![]() =
=![]() =25%,气体分压(p分)=气体总压(p总)×体积分数,则二氧化碳的气体分压=60%p,一氧化碳的气体分压=40%p,Kp=
=25%,气体分压(p分)=气体总压(p总)×体积分数,则二氧化碳的气体分压=60%p,一氧化碳的气体分压=40%p,Kp=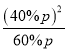 =
=![]() ,若向平衡体系中再充入V(CO2):V(CO)=5:4的混合气体,V(CO2):V(CO)= 5:4小于原平衡状态下的60%:40%=3:2,因此平衡逆向移动,故答案为:25%;
,若向平衡体系中再充入V(CO2):V(CO)=5:4的混合气体,V(CO2):V(CO)= 5:4小于原平衡状态下的60%:40%=3:2,因此平衡逆向移动,故答案为:25%; ![]() ;逆向。
;逆向。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】若把元素周期表原来的主副族及族号取消,从左到右共有18列,则下列说法中错误的是( )
A. 第17列为卤族元素
B. 第9列元素中没有非金属元素
C. 只有第2列元素原子的最外层有2个电子
D. 在整个18列元素中,第3列元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.标准状况下,1mol任何物质体积均为22.4L
C.3.01×1023个SO2分子的质量为32g
D.CH4的摩尔质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列说法不正确的是( )
A. M与R的质子数之和一定等于19 B. M、R可能分别处于第二周期和第三周期
C. M、R可能分别处于第六主族和第一主族 D. M和R的质子数之差可能等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是( )
A.用水可以区分乙酸乙酯和苯
B.有机物分子中都存在碳碳单键
C.聚乙烯属于高分子化合物
D.乙醇、油脂、淀粉是人们必需的营养物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 molH2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=+890.3kJ·mol-1
H=+890.3kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H= - 890.3 kJ·mol-1
H= - 890.3 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=890.3 kJ
H=890.3 kJ
D. 2H2(g)+O2(g)=2H2O(l) ![]() H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的一个原子失去两个电子被两个Y元素的原子获得,从而二者形成稳定的化合物Z,下列有关Z的推断不正确的是( )
A. Z是离子化合物 B. Z的化学式是XY2
C. Z的化学式是X2Y D. Z的熔点较高,熔融状态或溶于水都能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com