
【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )

选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D
【答案】C
【解析】
A.Fe2(SO4)3和NH3·H2O反应,生成红褐色Fe(OH)3沉淀;Fe2(SO4)3和Ba(OH)2反应,生成BaSO4白色沉淀;Fe2(SO4)3和铜反应,生成FeSO4和CuSO4,溶液显Fe2+的浅绿色,以及Cu2+蓝色的混合颜色;Fe2(SO4)3溶液显酸性,和石蕊试液混合,石蕊变红,错误;
B.钠投入Fe2(SO4)3溶液中,钠先和水反应生成NaOH,NaOH和Fe2(SO4)3反应,生成红褐色Fe(OH)3沉淀;Fe2(SO4)3和BaCl2反应,生成BaSO4白色沉淀;Fe2(SO4)3和FeO不反应;Fe2(SO4)3遇KSCN变红,错误;
C. Fe2(SO4)3和NaOH反应,生成红褐色Fe(OH)3沉淀;Fe2(SO4)3和Ba(NO3)2反应,生成BaSO4白色沉淀;Fe2(SO4)3和锌反应,生成ZnSO4和FeSO4,溶液显浅绿色;Fe2(SO4)3遇KSCN变红,正确;
D. Na2O2投入Fe2(SO4)3溶液中,Na2O2先和水反应生成NaOH,NaOH和Fe2(SO4)3反应,生成红褐色Fe(OH)3沉淀;Fe2(SO4)3和MgCl2不反应;Fe2(SO4)3和Fe反应生成FeSO4,溶液显浅绿色;Fe2(SO4)3溶液显酸性,和石蕊试液混合,石蕊变红,错误;
故选C。


科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
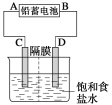
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 C—C 单键可以绕键轴旋转。某烃的结构简式如图,下列说法中正确的是
![]()
A. 该烃在核磁共振氢谱上有 6组信号峰
B. 1mol该烃完全燃烧消耗16.5mol O2
C. 分子中至少有 10个碳原子处于同一平面上
D. 该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、NH4+、I-、S2O32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C. ![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)己知:
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
则用NH3和O2制取N2H4的热化学方程式为__________________________________,该反应的化学平衡常数K=_______(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(
N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(![]() )随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。
)随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。

Ⅱ.2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)
(3)该反应能正向自发进行的原因是_____________________。
(4)恒温恒容下通入2 mol NH3和1 mol CO2进行上述反应,下列事实能证明反应已达平衡的是__________。
A.体系压强保持不变 B.气体平均密度保持不变
C.气体的平均摩尔质量保持不变 D.氨气的体积分数不变
Ⅲ.在恒温恒压条件下,向某密闭容器中通入2 mol SO2和1 mol O2,发生2SO2(g)+O2(g)![]() 2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。
2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2![]() 2NH3为放热反应,对该反应的下列说法中正确的是
2NH3为放热反应,对该反应的下列说法中正确的是
A.N2的能量一定高于NH3
B.H2的能量一定高于NH3
C.N2和H2的总能量一定高于NH3的总能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种金属晶体:Na、Zn、Po、Au,如图所示为金属原子的四种基本堆积模型。请回答以下问题:

(1)堆积方式的空间利用率最低的基本堆积模型是___(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
(2)金属原子在二维平面里放置得到密置层和非密置层,其中非密置层的配位数是_____,由非密置层互相错位堆积而成的基本堆积模型是_____(填编号),符合该堆积模型的金属晶体是_____(填化学符号)。
(3)按ABCABCABC……方式堆积的基本堆积模型是____(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、L八种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)A的名称是_______,B位于周期表中第_______周期第_______族。
(2)E单质的颜色是_______________。
(3)A元素与D元素形成化合物的电子式是___________________________。
(4)G的单质与水反应的化学方程式是______________________________________。
(5)F的元素符号是_____________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是___________,酸性最强的化学式是_____________,气态氢化物最稳定的化学式是_____________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是______________。
(8)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com