
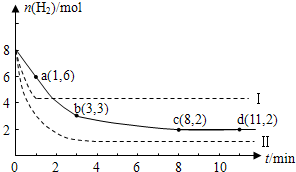
分析 (1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小,根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(2)利用三段式进行计算,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
转化率=$\frac{消耗量}{起始量}$×100%,气体压强之比等于气体物质的量之比.
解答 解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,分别计算不同时间内的反应速率:
0~1min内,v(H2)=$\frac{(8-6)mol}{2L×1min}$=1mol/(L•min);
1~3min内,v(H2)=$\frac{(6-3)mol}{2L×(3-1)}$=0.75mol/(L•min);
3~8min内,v(H2)=$\frac{(3-1)mol}{2L×(8-3)min}$=0.1mol/(L•min);
8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,
故答案为:0~a;1mol/(L•min);
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
二氧化碳的转化率=$\frac{2mol}{6mol}$×100%=33.3%
反应前后容器内的压强比等于气体物质的量之比:P前:P后=(6+8):(4+2+2+2)=14:10=7:5;
答:平衡时二氧化碳的转化率为33.3%,该条件下反应前后容器内的压强比为7:5.
点评 本题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.


科目:高中化学 来源: 题型:解答题
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的正反应为放热反应 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)△H<0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.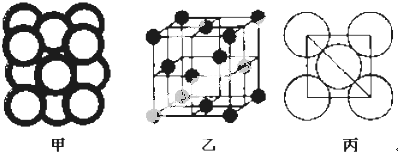
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 还原性:I->Br+>Cl- |
| C | 开始铜粉不溶解,溶液呈无色,后有气体放出,溶液呈蓝色 | 氧化性:NaNO3>H2SO4>Cu2+ |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
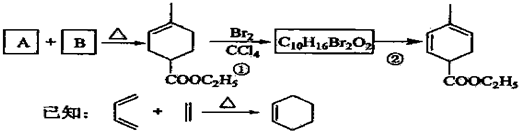
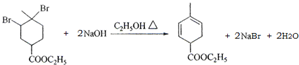 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com