
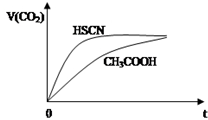
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
分析 (1)同温度下,等pH值,盐对应的酸越弱水解程度越大,相等PH值浓度越小;
(2)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大;
(3)温度不变,水的离子积常数、醋酸的电离平衡常数不变,在醋酸溶液中加入一定量氨气,一水合氨电离出的氢氧根离子和氢离子反应生成水,促进醋酸电离.
解答 解:(1)同温度下,等pH值,盐对应的酸越弱水解程度越大,相等PH值浓度越小,a.NaHCO3 b.NaCN c.Na2CO3对应的酸分别是:H2CO3、HCN、HCO3-、酸性强弱为:H2CO3>HCN>HCO3-,所以物质的量浓度由大到小的顺序为a>b>c,故答案为:a>b>c;
(2)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大,因Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快,所以c(SCN-)>c(CH3COO-),故答案为:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快;>;
(3)a、若保持温度不变,在醋酸溶液中加入一定量氨气,NH3+H2O?NH3.H2O?NH4++OH-,a.OH-+H+=H2O,所以促进醋酸电离,则c(CH3COO-)增大,故a错误;
b.OH-+H+=H2O,所以c(H+)减小,故b正确;
c.温度不变则Kw不变,故c错误;
d.温度不变,则醋酸电离平衡常数不变,故d错误;
故选b.
点评 本题考查了弱电解质电离,明确弱电解质的电离常数与酸根离子水解程度之间的关系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 已知25℃时,氢氟酸(HF)的电离平衡常数K=3.6×10-4,氢氰酸(HCN)的电离平衡常数K=4.9×10-10
已知25℃时,氢氟酸(HF)的电离平衡常数K=3.6×10-4,氢氰酸(HCN)的电离平衡常数K=4.9×10-10查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃,可以得到硅酸沉淀 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往品红溶液中通入SO2 | B. | NO中混入空气 | ||
| C. | 往氨水中滴加酚酞 | D. | 往Ba(OH)2溶液中滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 88.0g 干冰中含有的电子数为8.0NA | |
| B. | 常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | |
| C. | 常温下1.0L0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| D. | 1.2g金刚石中含有的碳碳键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P1=2P2 | B. | 2P1=P2 | C. | P1<P2<2P1 | D. | 2P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
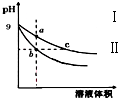 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com