
| A、22.4 L |
| B、44.8 L |
| C、11.2 L |
| D、4.48 L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)═CH3OH(g)+H2O(g) | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
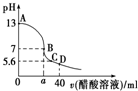 在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A、溶液酸性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B、C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-) |
| C、在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在D点:c(CH3COOH)=c(CH3COO-)+2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C2H4分子比例模型: |
| B、N2的结构式::N≡N: |
C、基态氮原子L层电子的轨道表示式: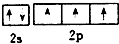 |
| D、基态溴原子的核外电子排布式:4s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
| B、在标准状况下,2.24L辛烷分子数为0.1NA |
| C、1L 0.1mol/L的Na3PO4溶液中含有0.1NA个PO43- |
| D、1mol NaCl中,所有Na+的最外层电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、加水稀释后,溶液中c(H+)和c(OH-)都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体 | ||||||
| B、在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 | ||||||
| C、用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | ||||||
D、亚硫酸钠具有较强的还原性,检验亚硫酸钠试样是否变质:试样
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Fe2+、NO3-、SO42- |
| B、K+、Ca2+、Cl-、HCO3- |
| C、Na+、Fe3+、SO42-、ClO- |
| D、Na+、K+、NO3-、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com