
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
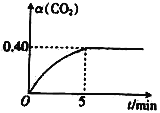
①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
【答案】-660 0.16mol/(L·min) 0.53 < b
【解析】
(1)根据盖斯定律,将已知的热化学方程式进行叠加,可得要求的反应的反应热;
(2)①结合CO2的转化率,计算CO2的转化量,然后根据化学反应速率是定义计算v(CO2),再根据物质反应速率与化学计算量关系计算v(CH3OH),根据平衡常数的定义式计算反应的化学平衡常数;
②反应开始时,两个容器的容积相同,容器内的气体的物质的量相同,A为恒温恒容,B为恒温、恒压,结合反应的正反应是气体体积减小的反应及压强对化学反应速率的影响分析;
③若对于A容器,若反应的v正>v逆,则反应未达到平衡,正向进行。
(1)①2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1,
2CO2(g) △H1=-566kJ·molˉ1,
②H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1,
H2(g)+CO2(g) △H2=-41kJ·molˉ1,
③CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
根据盖斯定律,①+②×2+①×![]() ,整理可④式CO(g)+2H2(g)+
,整理可④式CO(g)+2H2(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=-767kJ·molˉ1;
CO2(g)+2H2O(g) △H=-767kJ·molˉ1;
④-③,整理可得CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=-660kJ·molˉ1;
CO2(g)+2H2O(g) △H=-660kJ·molˉ1;
(2)对于A容器,反应在恒温、恒容条件下进行,反应开始时n(CO2)= 4.0mol,由于反应进行到5min时CO2的转化率是0.40,所以反应的CO2的物质的量为△n(CO2)= 4.0mol×0.4=1.6mol,所以用CO2表示的化学反应v(CO2)=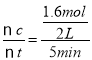 =0.16mol/(L·min)。根据物质反应时化学反应的速率比等于化学方程式中相应物质的化学计量数的比可知:v(CH3OH)=v(CO2)=0.16mol/(L·min);
=0.16mol/(L·min)。根据物质反应时化学反应的速率比等于化学方程式中相应物质的化学计量数的比可知:v(CH3OH)=v(CO2)=0.16mol/(L·min);
根据方程式CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)可知CO2反应了1.6mol,则会同时有4.8molH2发生反应,反应达到平衡时CO2的物质的量是2.4mol,H2的物质的量是2mol,反应产生1.6mol CH3OH和1.6molH2O,由于反应容器的容积是2L,因此各种物质的平衡浓度分别是:c(CO2)=1.2mol/L,c(H2)=1mol/L,c(CH3OH)=c(H2O)=0.8mol/L,则该反应达到平衡时该反应的化学平衡常数K=
CH3OH(g)+H2O(g)可知CO2反应了1.6mol,则会同时有4.8molH2发生反应,反应达到平衡时CO2的物质的量是2.4mol,H2的物质的量是2mol,反应产生1.6mol CH3OH和1.6molH2O,由于反应容器的容积是2L,因此各种物质的平衡浓度分别是:c(CO2)=1.2mol/L,c(H2)=1mol/L,c(CH3OH)=c(H2O)=0.8mol/L,则该反应达到平衡时该反应的化学平衡常数K=![]() =0.53;
=0.53;
②反应开始时,两个容器的容积相同,容器内的气体的物质的量相同,A为恒温恒容,B为恒温、恒压,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)的正反应是气体体积减小的反应,随着反应的进行,容器内气体的压强减小,要维持体系的压强不变,则B容器相当于A容器反应达到平衡后,对反应体系增大压强,增大压强,物质的浓度增大,化学反应速率增大,所以反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)<v(B)。
CH3OH(g)+H2O(g)的正反应是气体体积减小的反应,随着反应的进行,容器内气体的压强减小,要维持体系的压强不变,则B容器相当于A容器反应达到平衡后,对反应体系增大压强,增大压强,物质的浓度增大,化学反应速率增大,所以反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)<v(B)。
③a.该反应的正反应为放热反应,无论是反应正向进行还是反应达到平衡状态,体系内的压强都比反应开始时压强大。所以不能根据体系压强增大判断反应正向进行,v正>v逆,a错误;
b.该反应的正反应是气体体积减小的反应,若反应正向进行,则气体的物质的量减小,气体的平均相对分子质量增大,故可据此判断v正>v逆,b正确;
c.根据方程式可知:反应正向进行时,断裂H-H键的数目是形成C-O键数目的3倍,不可能是形成C-O键数目的2倍,c错误;
d.在任何条件下,v正(H2)=3v正(CO2),若v逆(CO2)=v正(H2),则v逆(CO2)=3v正(CO2),反应正向进行,所以v正<v逆,d错误;
故合理选项是b。


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
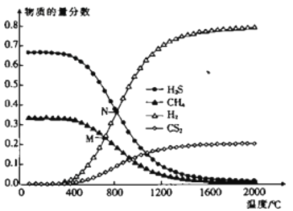
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是___________.
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸、②淀粉、③白酒、④食醋,你认为必须选用的物质有__________(填序号).
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号).
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平化学方程式:___Al+___NaNO3+___NaOH═___NaAlO2+___N2↑+___H2O.
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种常用的镇静、麻醉药物I,其合成路线如下。
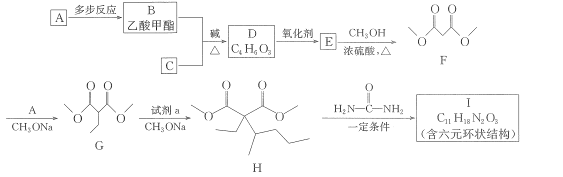
已知:①B、C互为同分异构体
② +R1OH;
+R1OH;
③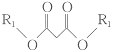 +R3Br+CH3ONa
+R3Br+CH3ONa +CH3OH+NaBr;
+CH3OH+NaBr;
④ + R1OH;
+ R1OH;
其中 R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为_____,G中官能团的名称为____,G-H的反应类型为____。
(2)I的结构简式为__。
(3)写出 B+C→D的化学方程式:__________________
(4)设计实验区分B、D,所选用的试剂为___________________。
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有______种,写出其中互为顺反异构物质的结构简式:___________。
a.能发生银镜反应;b.能发生水解反应;c.能使Br2的CCl4溶液褪色;d.能与Na反应。
(6)参照上述合成路线,请写出以 CH2BrCH2CH2Br、CH3OH、CH3ONa 为原料(无机试剂任选),制备 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池比传统电池有更长的循环寿命和功率密度,其工作原理如图所示。下列有关该电池的说法正确的是

A.充电时N电极上发生氧化反应
B.放电时M极的电极反应式为3I--2e-=I3-
C.充电时Li+通过离子交换膜从M池进入N池
D.放电时每当有2 mole-转移时生成1 mol 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com