

分析 (1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ•mol-1
由盖斯定律②×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),根据盖斯定律计算得到反应的焓变,热化学方程式的意义:1molCH4还原NO生成N2,则放出的热量值等于焓变值;
(2)酸性条件下,亚铁离子和硝酸根离子反应生成铁离子、一氧化氮和水;
(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,Pt电极为阳极,在电解池的阴极上发生得电子的还原反应,根据电极反应式结合电子守恒来计算;
(4)根据b点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T1时化学平衡常数K;
(5)A、因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.反应前后气体体积不变,压强变化对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
(6)①根据温度对催化剂活性的影响分析;
②根据温度对化学平衡移动的影响分析.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ•mol-1
由盖斯定律②×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),所以焓变△H=(-867kJ•mol-1)×2-(-574kJ•mol-1)=-1160kJ•mol-1,若用4.48L即0.2molCH4还原NO生成N2,则放出的热量为1160kJ/mol×0.2mol=232kJ,
故答案为:232;
(2)酸性条件下,亚铁离子和硝酸根离子反应生成铁离子、一氧化氮和水,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO3-+12H++10e-=N2↑+6H2O,Pt电极为阳极,阳极反应为2H2O-4e-=O2+4H+,当转移20mol电子时,阳极消耗10mol水,产生20molH+进入阴极室,阳极质量减少180g,
故答案为:2NO3-+12H++10e-=N2↑+6H2O;180;
(4)T1时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{4}$=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1,
T1时化学平衡常数K=$\frac{c{\;}^{5}(CO{\;}_{2})}{c{\;}^{5}(CO)}$=$\frac{1.6{\;}^{5}}{0.{4}^{5}}$=1024,
故答案为:1024;
(5)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
(6)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,是因为250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动,
故答案为:250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
点评 本题考查热化学反应方程式计算、化学平衡常数的相关计算、化学平衡移动原理,综合性很强,难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 正 极 | 负 极 | 电解质溶液 | |
| A | Cu | Fe | FeCl3 |
| B | C | Fe | Fe(NO3)3 |
| C | Fe | Zn | Fe2(SO4)3 |
| D | Ag | Fe | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 聚合物的链节是(如图2) | |
| B. | 聚合物的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHCl | |
| D. | 若n为聚合度,则其相对分子质量为97n |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
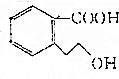 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | M的分子式为C9H10O3 | |
| B. | M 可使酸性KMnO4溶液褪色 | |
| C. | 1 mol M完全燃烧消耗10 mol O2 | |
| D. | 1 mol M能与足量Na反应生成0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
 (1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 过滤得到滤液,选用④、⑤和⑦ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com