
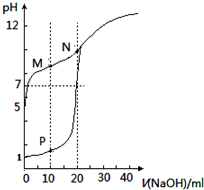
| A. | 滴定时均可用酚酞作指示剂 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液混合,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | 向N点的溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-) |
分析 A.碱滴定酸时,溶液由酸性变为碱性,用酚酞作指示剂溶液由无色变为红色;
B.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,由物料守恒可知:2c(Na+)=c(X-)+c(HX),结合电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-)判断;
C.P点溶液中NaCl、HCl物质的量相等,N点为NaX溶液,NaX物质的量为HCl的2倍,P、N点溶液混合后为NaCl、NaX、HX混合溶液,且溶液中NaX与HX的浓度相等,由于X-的水解程度大于HX的电离程度,呈碱性;
D.根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(X-)+c(OH-),溶液pH=7,则c(Na+)=c(Cl-)+c(X-),由物料守恒可知c(Na+)=c(X-)+c(HX),联立可得c(HX)=c(Cl-),而溶液为NaCl、NaX、HX的混合溶液,相同浓度下X-的水解程度大于HX的电离程度,由于溶液为中性,则溶液中c(NaX)<c(HX).
解答 解:A.碱滴定酸时,溶液由酸性变为碱性,用酚酞作指示剂溶液由无色变为红色,NaOH滴定HCl、HX溶液都是由酸性变为碱性,都可以用酚酞作指示剂,故A正确;
B.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,由物料守恒可知:2c(Na+)=c(X-)+c(HX),结合电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-),联立可得:c(X-)+c(HX)+2c(H+)=2c(X-)+2c(OH-),整理得:c(HX)-c(X-)=2c(OH-)-2c(H+)>c(OH-)-c(H+),故B正确;
C.P点溶液中NaCl、HCl物质的量相等,N点为NaX溶液,NaX物质的量为HCl的2倍,混合后为NaCl、NaX、HX混合溶液,且溶液中NaX与HX的浓度相等,由于X-的水解程度大于HX的电离程度,呈碱性,则$\frac{{K}_{W}}{c({H}^{+})}$>1.0×10-7mol/L,故C错误;
D.根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(X-)+c(OH-),溶液pH=7,则c(Na+)=c(Cl-)+c(X-),由物料守恒可知c(Na+)=c(X-)+c(HX),联立可得c(HX)=c(Cl-),而溶液为NaCl、NaX、HX的混合溶液,相同浓度下X-的水解程度大于HX的电离程度,由于溶液为中性,则溶液中c(NaX)<c(HX),故溶液中c(Na+)>c(HX)=c(Cl-),故D正确.
故选:C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析及判断能力,明确各点溶液中溶质成分及其性质是解本题关键,会根据溶液酸碱性确定HX电离程度和NaX水解程度的关系,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠证明铁的还原性比钠强 | |
| C. | 若用戴维法与盖•吕萨克法制得等量的钠,则两反应各自转移的电子数相同 | |
| D. | 电解熔融氯化钠制钠的电解槽中(如上图),石墨为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)<c(Na+)+c(OH-) | |
| D. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
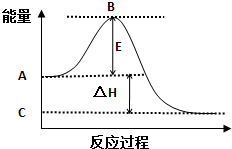 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
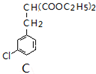 $\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$
$\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$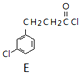 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$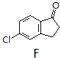
 或
或 (任写一种).
(任写一种). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com