
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
分析 A、金属铜和浓硝酸以及稀硝酸均会发生反应;
B、Fe为变价金属,与弱氧化剂S反应生成低价化合物;
C、电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上不会Fe、Al;
D、反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂.
解答 解:A、金属铜和浓硝酸以及稀硝酸均会发生反应,1mol铜片投入含4mol的浓硝酸中,会恰好反应,故A正确;
B、Al与S直接化合可以得到Al2S3,Fe与S直接化合得到FeS,故B错误.
C、电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上不会Fe、Al,故C错误;
D、FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,所以FeS2中S元素部分被氧化,部分被还原,故D错误;
故选A.
点评 本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握物质的性质及发生的反应、电解原理、氧化还原反应等为解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钾与铯同一主族,铯比钾更容易从水中置换出氢 | |
| B. | 溴化钾与碘化钾溶液置于空气中,溴化钾更容易变质 | |
| C. | 卤族元素气态氢化物的水溶液的酸性,从上到下依次减弱 | |
| D. | 卤族元素最高价氧化物对应水化物的酸性从上到下增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | N | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -2 | -3 | -2 | |
| A. | 气态氢化物的稳定性:N>Y | |
| B. | M(OH)2的碱性比XOH的碱性强 | |
| C. | 元素X和Q形成的化合物只可能有离子键 | |
| D. | X、Z、N的最高价氧化物对应的水化物之间可两两相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
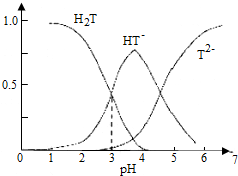
| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com