
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
分析 金属的金属性越强,其单质与酸或水反应生成氢气越容易,其最高价氧化物的水化物碱性越强;较活泼的金属能置换出较不活泼金属,据此判断金属性强弱.
解答 解:金属的金属性越强,其单质与酸或水反应生成氢气越容易,其最高价氧化物的水化物碱性越强;较活泼的金属能置换出较不活泼金属,只有D能与水反应生成氢气,说明D金属性很强;
将A投入C的盐溶液中可置换出金属C,说明金属性A>C;
B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,说明金属性B>A,
所以金属性强弱顺序是D>B>A>C,故选B.
点评 本题考查金属的金属性强弱判断,注意不能根据失电子多少判断金属性强弱,要根据失电子难易程度判断金属性强弱.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲图中的小黑点疏密表述电子在核外空间出现机会的大小 | |
| B. | 甲图中的每个小黑点表示1个电子 | |
| C. | 乙图表示1s电子只能在球体内出现 | |
| D. | 乙图表明1s轨道呈圆形,有无数对称轴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: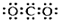 | B. | Na+的结构示意图: | ||
| C. | 氯离子:Cl | D. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸溶液没有产生白色沉淀,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
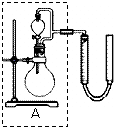 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com