
分析 计算混合气体物质的量,根据总质量、总物质的量列方程计算CO和CO2,根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令CO和CO2的物质的量分别为xmol、ymol,根据二者物质的量及质量列方程计算x、y的值,可得二者物质的量之比;利用$\frac{CO的物质的量}{总物质的量}$计算CO的体积分数,根据m=nM计算CO的质量,再利用$\frac{CO的质量}{总质量}$×100%计算CO的质量分数,计算C原子、O原子的物质的量,据此判断C原子与O原子数目之比;根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量.
解答 解:标况下CO和CO2组成的混合气体6.72L,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
令CO和CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.3\\;}\\{28x+44y=12g}\end{array}\right.$
解得:x=0.075,y=0.225
混合物中CO和CO2的物质的量比为0.075:0.225=1:3,
CO的体积分数为$\frac{0.075}{0.3}$×100%=25%,
CO的质量为0.075mol×28g/mol=2.1g,故CO的质量分数为$\frac{2.1g}{12g}$×100%=17.5%,
所以混合气体中C和O两种原子的数目之比为(0.075mol+0.225mol):(0.075mol+2×0.225mol)=4:7,
混合气体平均摩尔质量为$\frac{12g}{0.3mol}$=40g/mol,密度是$\frac{12g}{6.72L}$=1.79g/L,对氢气的相对密度是$\frac{40}{2}$=20,
故答案为:1:3; 25%; 17.5%; 4:7; 40;1.79; 20.
点评 本题考查物质的量的相关计算,题目难度不大,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的原子序数呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
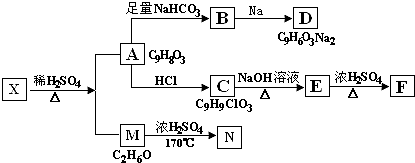
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;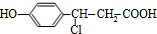 +3NaOH$→_{△}^{H_{2}O}$
+3NaOH$→_{△}^{H_{2}O}$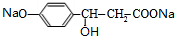 +NaCl+2H2O.
+NaCl+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有金属与非金属元素才能形成离子化合物 | |
| B. | 质子数与核外电子数相等的微粒一定是原子 | |
| C. | 简单离子最外层电子数只能是2或8 | |
| D. | 元素周期表中共有18列,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com