
 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:分析 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B的焰色反应呈黄色,则B为Na;C的氢化物是一种强酸,则C为Cl;其浓溶液可与A、E的化合物反应生成C的单质,应是二氧化锰与浓盐酸反应生成氯气,可知E为Mn元素;D是一种金属元素,其基态原子中有6个未成对电子,处于第四周期,外围电子排布为3d54s1,则D为Cr,据此解答.
解答 解:A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B的焰色反应呈黄色,则B为Na;C的氢化物是一种强酸,则C为Cl;其浓溶液可与A、E的化合物反应生成C的单质,应是二氧化锰与浓盐酸反应生成氯气,可知E为Mn元素;D是一种金属元素,其基态原子中有6个未成对电子,处于第四周期,外围电子排布为3d54s1,则D为Cr.
(1)元素E为锰,前四周期元素中,D是一种金属元素,其基态原子中有6个未成对电子,处于第四周期,基态原子价层电子排布式为3d54s1,
故答案为:锰;3d54s1;
(2)C为Cl,其上一周期同族元素的氢化物为HF,HF分子间存在氢键,而HCl分子间无氢键,故HCl的沸点低于HF,
故答案为:HF分子间存在氢键,而HCl分子间无氢键;
(3)A为O元素、C为Cl元素,二者形成的氧化物中O元素表现负化合价,对键合电子吸引力更大,故电负性大小顺序是O>Cl,Cl的最高价含氧酸根为ClO4-,Cl原子价层电子对数为4+$\frac{7+1-2×4}{2}$=4,没有孤对电子,故其空间构型为正四面体,其Cl原子的杂化类型为sp3杂化,
故答案为:O>Cl;正四面体;sp3;
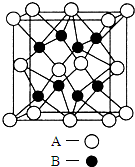
(4)晶胞中Na原子数目为8,O原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Na、O原子数目之比为8:4=2:1,故该晶胞的化学式为Na2O,以上面面心中A离子研究,与之相邻的B离子有8个,另外4个位于上面晶胞内部,故A离子的配位数为8,该晶体属于离子晶体,
故答案为:Na2O;8;离子晶体;
(5)白色球与周围的8个黑色球形成立方体结构,黑色球位于立方体顶点、白色球位于立方体体心,该晶胞的边长为a×10-10 cm,晶胞内部上4个黑色球形成的平面、下4个黑色球形成的平面、及面心的4个白色球形成的平面与上下两面的面间距离相等,则两个黑色球之间的距离为$\frac{1}{2}$×a×10-10 cm,体心中白色球与位于立方体体对角线上的2个黑色球相邻,立方体体对角线长为$\frac{1}{2}$×a×10-10 cm×$\sqrt{3}$,故则距离最近的A、B离子间的距离为($\frac{1}{2}$×a×10-10 cm×$\sqrt{3}$)×$\frac{1}{2}$=$\frac{\sqrt{3}}{4}$×a×10-10 cm,
故答案为:$\frac{\sqrt{3}}{4}$×a×10-10.
点评 本题是对物质结构的考查,涉及电负性、核外电子排布、微粒结构、杂化轨道、晶胞计算等,(5)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物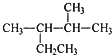 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、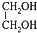 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: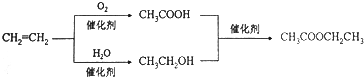 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
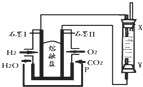 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
H2S水溶液中存在电离平衡H2S ?H++HS-和HS-
?H++HS-和HS- ?H++S2-。若向H2S溶液
?H++S2-。若向H2S溶液
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com