
(18分,每小题2分)用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸。可供选择①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有 (填代号) .
(2)经计算,需浓硫酸的体积为 mL(保留一位小数); 。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用 玻璃棒 .转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度 cm处,改用 滴加蒸馏水,使 .塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将 (选填“偏高”、“偏低”或“不变”)
(1)(2)(7)(8) (2) 5.4ml (3) 500 引流 烧杯和玻璃棒 1-2 胶头滴管 凹液面最低处与刻度线相切 (4)偏高
解析试题分析:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平.需要的仪器为:①玻璃棒、③烧烧杯、④胶头滴管、⑤量筒、⑥500mL容量瓶,所以上述仪器中,在配制稀硫酸时用不到的有(2)(7)(8)(2)质量分数为98%、密度为1.84g?cm-3的浓H2SO4的物质的量浓度为 mol/L=18.4mol/L,令需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,则VmL×1.84g/cm3×98%=500mL×0.2mol?L-1×98g/mol,解得V=5.4ml;(3)配制500mL0.2mol/L的稀H2SO4需要500mL容量瓶;转移时应用玻璃棒引流,转移完毕,玻璃棒、烧杯壁上沾有少量的硫酸,为减少误差需要洗涤,并将洗涤液移入容量瓶,当蒸馏水滴加到液面接近刻度1-2cm处,为便于控制改用胶头滴管加蒸馏水,使凹液面最低处与刻度线相切 ;(4)定容时,俯视刻度线,导致所配溶液的体积偏小,所配溶液的浓度偏高。
mol/L=18.4mol/L,令需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,则VmL×1.84g/cm3×98%=500mL×0.2mol?L-1×98g/mol,解得V=5.4ml;(3)配制500mL0.2mol/L的稀H2SO4需要500mL容量瓶;转移时应用玻璃棒引流,转移完毕,玻璃棒、烧杯壁上沾有少量的硫酸,为减少误差需要洗涤,并将洗涤液移入容量瓶,当蒸馏水滴加到液面接近刻度1-2cm处,为便于控制改用胶头滴管加蒸馏水,使凹液面最低处与刻度线相切 ;(4)定容时,俯视刻度线,导致所配溶液的体积偏小,所配溶液的浓度偏高。
考点:考查一定物质的量溶液的配制、误差分析等知识。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:问答题
实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
⑴此浓盐酸的物质的量浓度是多少?(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL ?(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号): 。
①计算 ②装瓶③用50 mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
欲配制480mL 0.2mol/L的NaCl溶液,回答下列问题:
(1)应用托盘天平准确称取固体NaCl g。
(2)以下是实验操作步骤,正确的操作顺序是:
①称取所需质量的NaCl
②将溶液转移到容量瓶内
③用蒸馏水洗涤烧杯2~3次,将洗涤液全部移入容量瓶中,摇匀
④改用胶头滴管,小心滴入蒸馏水至刻度
⑤仔细地把蒸馏水注入容量瓶中,直到液面接近刻度线1cm~2cm处
⑥塞上瓶塞,反复上下颠倒,摇匀
⑦将称取的NaCl固体,加适量蒸馏水,搅拌溶解后冷却
(3)若实验遇到下列情况,所配制的溶液浓度偏小的操作是
| A.烧杯中NaCl溶液移入容量瓶后没有洗涤烧杯 |
| B.定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线 |
| C.实验用的容量瓶洗净后未干燥,里面含有少量水 |
| D.定容时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验室用密度为1.19g/mL,质量分数为36.5% 浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
每空2分,共20分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。
根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器
是 (填仪器名称)。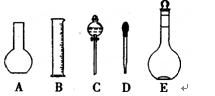
(2)下列操作中,是容量瓶所具备的功能有 。
A 配制一定体积准确浓度的标准溶液 B 贮存溶液
C 配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液
E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。 配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低的是 。
A.用滤纸称量NaOH
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分,每小题2分)现有九种物质(1)铝线(2)石墨(3)氯气(4)硫酸镁晶体(5)纯硫酸(6)金刚石(7)石灰水(8)乙醇(9)熔融的硝酸钾
其中能导电的是 ;属于电解质的是
既不是电解质也不是非电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。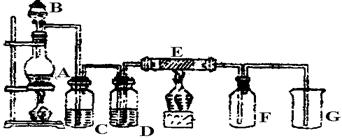
(1)A中发生的化学反应的离子方程式为 。
(2)C中各装的药品是:__________;
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2与SO2等物质的量通入水中则无漂白作用,试写出化学方程式 。
(6)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①当有0.2mole-转移时被氧化的HCl的质量是 ;
②如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将 。
| A.≥1.68L | B.>1.68L | C.≤1.68L | D.<1.68L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化: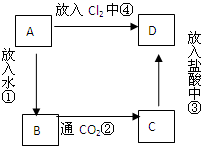
(1)写出化学式:A B C D
(2)写出①②③④的化学方程式。
①
②
③
④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com