
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
分析 A.硝酸具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
B.二者反应生成硫单质和水,硫不溶液水是沉淀;
C.二者反应生成氢离子与氢氧根离子反应生成水;
D.不符合反应客观事实.
解答 解:A.HNO3会将Fe3O4中的+2价Fe氧化成+3价,稀 HNO3被还原为NO,应写为3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故A错误;
B.将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S↓+2H2O,故B错误;
C.氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O,故C正确;
D.向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意氢氧化铝只能溶解在强碱溶液中,注意化学符合使用的规范性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 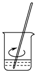 溶解 | B. |  转移 | C. |  定容 | D. |  摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: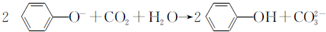 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

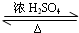 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铝、二氧化硫 | ||
| C. | 液态的醋酸、酒精 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 5:7 | D. | 7:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com