
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
【答案】最外层电子数 电子层数 电子层数 最外层电子数 8 Ne Ar Mg 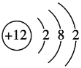
【解析】
(1)核电荷数为6和14的元素原子,原子结构示意图分别为![]() 、
、![]() ,它们的最外层电子数相同,电子层数不相同;核电荷数为15和16的元素原子,原子结构示意图分别为
,它们的最外层电子数相同,电子层数不相同;核电荷数为15和16的元素原子,原子结构示意图分别为![]() 、
、![]() ,它们的电子层数相同,最外层电子数不相同;核电荷数为10和18的元素原子,它们的原子结构示意图
,它们的电子层数相同,最外层电子数不相同;核电荷数为10和18的元素原子,它们的原子结构示意图![]() 、
、![]() ,最外层电子数均为8,它们的元素符号分别是Ne、Ar。答案为:最外层电子数;电子层数;电子层数;最外层电子数;8;Ne;Ar;
,最外层电子数均为8,它们的元素符号分别是Ne、Ar。答案为:最外层电子数;电子层数;电子层数;最外层电子数;8;Ne;Ar;
(2)根据原子核外有三个电子层,可知该元素的核电荷数大于等于11,小于等于18。设该元素原子的核外电子数为![]() ,则
,则![]() ,由
,由![]() 为整数可知,
为整数可知,![]() 或18(排除),核电荷数为12的元素是镁,
或18(排除),核电荷数为12的元素是镁,![]() 的原子结构示意图为
的原子结构示意图为![]() 。答案为:
。答案为:![]() 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
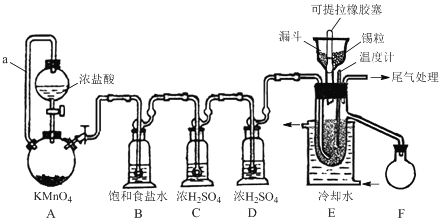
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。
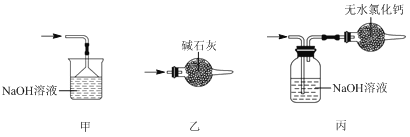
(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~g7种短周期主族元素,它们在元素周期表中的相对位置如图所示,请回答下列问题:
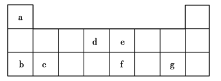
(1)下列选项中,元素的原子间最容易形成离子键的是______(填序号,下同),元素的原子间最容易形成共价键的是______。
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.
C.![]() 和
和![]() D.
D.![]() 和
和![]()
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是______(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为______。
(4)![]() 与
与![]() 可形成一种化合物
可形成一种化合物![]() ,其含有的化学键类型为______,其与过量稀盐酸反应的化学方程式为______。
,其含有的化学键类型为______,其与过量稀盐酸反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)填写表中空格:
符号 | 质子数 | 电子数 |
___ | 1 | 0 |
| ___ | ___ |
| ___ | b |
(2)元素周期表中第五周期共有___种元素,若第五周期ⅤA族元素的原子序数为![]() ,则第五周期ⅡA族元素的原子序数为___(用含
,则第五周期ⅡA族元素的原子序数为___(用含![]() 的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
(3)紧邻第Ⅷ族之后的一个纵行为第____族,元素周期表中所含元素种数最多的族是第___族。
(4)某元素的一种同位素![]() 的原子的质量数为
的原子的质量数为![]() ,含
,含![]() 个中子,它与
个中子,它与![]() 原子组成
原子组成![]() 分子,则
分子,则![]()
![]()
![]() 中所含质子的物质的量是___
中所含质子的物质的量是___![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
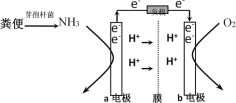
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
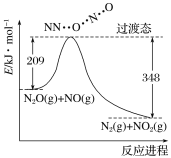
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体的性质与晶体类型和结构紧密相关。
(1)氯酸钾熔化时克服的作用力是______;二氧化硅熔化时克服的作用力是______;碘升华时克服的作用力是______。三种晶体的熔点由高到低的顺序是______(填化学式)。
(2)下列六种晶体:①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铷(![]() )是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
)是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
(1)铷位于第______周期,其原子半径比钠元素的原子半径______(填“大”或“小”)。
(2)铷单质性质活泼,写出在点燃条件下它与氯气反应的化学方程式:________________________;铷单质易与水反应,反应的离子方程式为________________________,实验表明铷与水反应比钠与水反应______(填“剧烈”或“缓慢”);反应过程中铷在水______(填“面”或“底”)与水反应,原因是__________________。
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与![]() 反应的化学方程式:________________。
反应的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com