
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
分析 用铜作电极电解硝酸银溶液时,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu 2+,阴极上银离子得电子生成银,电极反应式为Ag++e-=Ag,电池反应式为Cu+2Ag+=2Ag+Cu 2+,两个电极质量差为溶解铜的质量和析出银的质量之和,根据转移电子相等计算两个电极的质量.
解答 解:用铜作电极电解硝酸银溶液时,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu 2+,阴极上银离子得电子生成银,电极反应式为Ag++e-=Ag,电池反应式为Cu+2Ag+=2Ag+Cu 2+,假设阳极质量减少xg,则阳极质量为(100-x)g,阴极质量为(100+×2×108)g,根据题意可得:(100-x)g+14g=(100+×2×108)g,x=3.2g,阳极质量变为96.8g,阴极质量为110.8g,
故选B.
点评 本题以电解原理为载体考查物质的量的计算,正确理解“电解一段时间后两个电极质量差为溶解铜的质量和析出银的质量之和”为解答本题关键,再结合转移电子守恒解答即可,本题还可以采用排除法解答,阳极质量减少阴极质量增加,根据转移电子守恒知溶解铜的质量和析出银的质量不等,从而得出正确选项.


科目:高中化学 来源: 题型:选择题
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
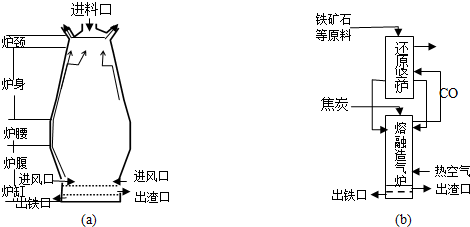
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +352 | B. | +132 | C. | -120 | D. | -330 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是负极 | |
| C. | 电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,锌被硫酸溶解,所以才产生电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 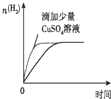 等质量锌粉与足量盐酸反应 | |
| B. | 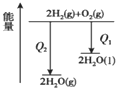 氢气与氧气反应中的能量变化 | |
| C. | 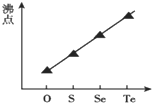 气态氢化物沸点 | |
| D. |  催化反应与非催化反应过程中的能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com