
向盛有硫酸铜溶液的试管中滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液无明显变化
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:阅读理解
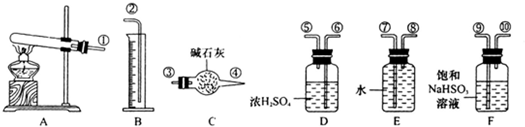
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
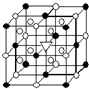 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
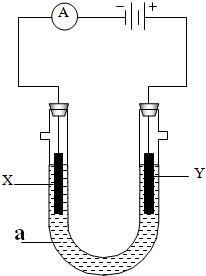 使用如图所示装置进行电解实验,其中X、Y均为石墨电极,U形管中盛有200mL溶液a.试回答下列问题:
使用如图所示装置进行电解实验,其中X、Y均为石墨电极,U形管中盛有200mL溶液a.试回答下列问题:查看答案和解析>>
科目:高中化学 来源:志鸿系列训练必修一化学鲁科版 题型:022
指出下列反应的主要现象,并写出有关反应的离子方程式.
(1)向盛有硝酸银溶液的试管中滴加稀盐酸.
现象:_____________________________________;
离子方程式:_______________________________.
(2)向盛有硫酸铜溶液的试管中注入氢氧化钠溶液.
现象:_____________________________________;
离子方程式:_______________________________.
(3)向盛有氢氧化钠溶液和少许酚酞试液的试管中滴加稀硫酸.
现象:_____________________________________;
离子方程式:_______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究。
(1)同学们首先排除了试剂的成分是硫酸铜、硫酸铁、硫酸亚铁等的可能,理由是 _______ ___。
(2)取出少量溶液置于试管中,向其中滴入石蕊试液,石蕊试液呈现红色,同学们认为可以排除硫酸钠、硫酸钾等,理由是_______ _______________;但是不能排除是硫酸铵的可能性,其原因是(用离子方程式表示)____ ____。
(3)另取出少量溶液置于试管中,向其中加入锌粒,有大量无色气泡快速冒出。根据此现象,可推测溶质可能是下列物质中的__________________(填字母代号),生成气体的有关反应的离子方程式为_________ _________________________ 。
A.NaHSO4 B.(NH4)2SO4 C.MgSO4 D.H2SO4 E.Al2 (SO4)3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com