
关于化学平衡常数的叙述中,正确的是( )
|
| A. | 只与化学反应本身和温度有关 |
|
| B. | 只与反应的温度有关 |
|
| C. | 与化学反应本身和温度有关,并且会受到起始浓度的影响 |
|
| D. | 只与化学反应本身有关,与其他任何条件无关的一个不变的常数 |
考点:
化学平衡常数的含义.
专题:
化学平衡专题.
分析:
平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数与温度有关,注意同一反应化学计量数不同,平衡常数不同,所以化学平衡常数与化学反应本身也有关.
解答:
解:平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数与温度有关,注意同一反应化学计量数不同,平衡常数不同,所以化学平衡常数与化学反应本身也有关;所以化学平衡常数只与化学反应本身和温度有关,
故选A.
点评:
本题考查了化学平衡常数的含义,难度不大,注意化学平衡常数只与化学反应本身和温度有关,同一反应化学计量数不同,平衡常数不同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将2.8 g Fe加入含9.45 g HNO3的稀溶液中,充分反应后测得Fe和HNO3都无剩余若HNO3被还原为NO,则Fe最终生成( )
A.Fe(NO3)3 B.Fe(NO3)2 C.Fe(NO3)3和Fe(NO3)2 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中存在五种离子: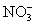 、
、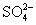 、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
A.Fe2+ B.Ba2+ C.Cl- D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生 反应,说明亚硝酸钠具有 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具
有 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F====6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是 ,还原剂是 ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为 ,
反应中每生成0.1 mol H2,转移电子数为 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨做电极电解CuSO4溶液.通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
|
| A. | CuSO4 | B. | H2O | C. | CuO | D. | CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
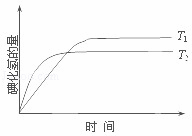
在密闭容器中进行如下反应:H2(g)+I2(g)⇌2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
|
| A. | T1>T2,△H>0 | B. | T1>T2,△H<0 | C. | T1<T2,△H>0 | D. | T1<T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42﹣的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
|
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列单质或化合物性质的描述正确的是( )
A.NaHSO4水溶液显中性
B.SiO2与酸、碱均不反应
C.NO2溶于水时发生氧化还原反应
D.Fe在足量Cl2中燃烧生成和FeCl2和FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com