
”¾ĢāÄæ”æĮņĢśæóÉÕŌü£ØÖ÷ŅŖ³É·ÖĪŖFe2O3”¢Fe3O4”¢FeO”¢SiO2µČ£©ŹĒÉś²śĮņĖįµÄ¹¤Ņµ·ĻŌü£¬Ęä×ŪŗĻĄūÓƶŌ»·¾³±£»¤¾ßÓŠĻÖŹµŅāŅ壮ĄūÓĆĮņĢśæóÉÕŌüÖʱøĢśŗģµČ²śĘ·µÄŹµŃéĮ÷³ĢČēĻĀ£ŗ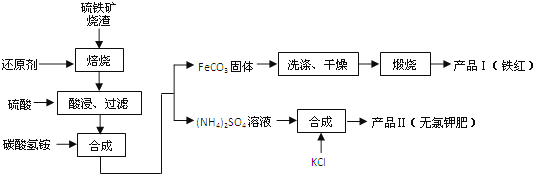
ŅŃÖŖ¼øÖÖŃĪµÄČܽā¶ČĖęĪĀ¶Č±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ėį½ž”¢¹żĀĖŗóĀĖŅŗÖŠµÄ½šŹōŃōĄė×ÓŹĒ”” £®
£Ø2£©ģŃÉÕFeCO3Éś³É²śĘ·IµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ”” ””£®ŹµŃéŹŅ½ųŠŠģŃÉÕ²Ł×÷ĖłŠčŅĒĘ÷³żĮĖ¾Ę¾«µĘ”¢ÄąČż½Ē”¢Čż½Å¼Ü”¢²£Į§°ōĶā£¬»¹ÓŠ £®
£Ø3£©²śĘ·¢ņµÄ»ÆѧŹ½ĪŖ £¬ĪŖĮĖ»ńµĆ²śĘ·¢ņ£¬Ļņ£ØNH4£©2SO4ČÜŅŗÖŠ¼ÓČėKClČÜŅŗŗ󣬻¹ŠčŅŖ½ųŠŠµÄ²Ł×÷ŹĒ£ŗ £®
£Ø4£©¼ģŃé²śĘ·IIÖŠŹĒ·ńŗ¬ÓŠĀČ»ÆĪļŌÓÖŹµÄŹµŃé²Ł×÷ŹĒ£ŗȔɣĮæ²śĘ·¢ņÓŚŹŌ¹ÜÖŠÅä³ÉČÜŅŗ£¬ £®
”¾“š°ø”æFe2+£»4FeCO3+O2![]() 2Fe2O3+4CO2£»ŪįŪö”¢ŪįŪöĒÆ£»K2SO4£»Õō·¢½į¾§”¢³ĆČČ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»µĪ¼Ó¹żĮæBa£ØNO3£©2ČÜŅŗ£¬¹żĀĖŗóĻņĀĖŅŗµĪ¼ÓAgNO3ČÜŅŗ
2Fe2O3+4CO2£»ŪįŪö”¢ŪįŪöĒÆ£»K2SO4£»Õō·¢½į¾§”¢³ĆČČ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»µĪ¼Ó¹żĮæBa£ØNO3£©2ČÜŅŗ£¬¹żĀĖŗóĻņĀĖŅŗµĪ¼ÓAgNO3ČÜŅŗ
”¾½āĪö”æ½ā£ŗ£Ø1£©ŅņFe2O3”¢Fe3O4”¢FeOÓė»¹Ō¼Į·“Ӧɜ³ÉĢś£¬ĢśŗĶĻ”ĮņĖį·“Ӧɜ³ÉĮņĖįŃĒĢśŗĶĒāĘų£¬ĖłŅŌĀĖŅŗÖŠµÄÖ÷ŅŖČÜÖŹŹĒĮņĖįŃĒĢś£¬ĖłŅŌ“š°øŹĒ£ŗFe2+£»
£Ø2£©ŅņĢ¼ĖįŃĒĢśÓėŃõĘų·“Ӧɜ³ÉĮĖŃõ»ÆĢśŗŠ¶žŃõ»ÆĢ¼£¬4FeCO3+O2![]() 2Fe2O3+4CO2£»ŅņŹµŃéŹŅ½ųŠŠģŃÉÕ²Ł×÷ĖłŠčŅĒĘ÷ÓŠ¾Ę¾«µĘ”¢ÄąČż½Ē”¢Čż½Å¼Ü”¢²£Į§°ō”¢ŪįŪö”¢ŪįŪöĒÆ£¬
2Fe2O3+4CO2£»ŅņŹµŃéŹŅ½ųŠŠģŃÉÕ²Ł×÷ĖłŠčŅĒĘ÷ÓŠ¾Ę¾«µĘ”¢ÄąČż½Ē”¢Čż½Å¼Ü”¢²£Į§°ō”¢ŪįŪö”¢ŪįŪöĒÆ£¬
ĖłŅŌ“š°øŹĒ£ŗ4FeCO3+O2![]() 2Fe2O3+4CO2£» ŪįŪö”¢ŪįŪöĒÆ£»
2Fe2O3+4CO2£» ŪįŪö”¢ŪįŪöĒÆ£»
£Ø3£©ĮņĖįļ§ÓėĀČ»Æ¼Ų·“Ӧɜ³ÉĮņĖį¼ŲŗĶĀČ»Æļ§£»ŅņĮņĖį¼ŲµÄČܽā¶ČĖęĪĀ¶Č±ä»Æ²»“ó£¬æÉÓĆÕō·¢½į¾§”¢³ĆČČ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆµ½ĮņĖį¼Ų£¬
ĖłŅŌ“š°øŹĒ£ŗK2SO4£»Õō·¢½į¾§”¢³ĆČČ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»
£Ø4£©Ņņ¼ģŃé²śĘ·IIÖŠŹĒ·ńŗ¬ÓŠĀČ»ÆĪļŌÓÖŹŠčĻČ³żČ„SO4 £¬ ŌŁ¼ģŃéCl© £¬ ĖłŅŌµĪ¼Ó¹żĮæBa£ØNO3£©2ČÜŅŗ£¬¹żĀĖŗóĻņĀĖŅŗµĪ¼ÓAgNO3ČÜŅŗ£¬
ĖłŅŌ“š°øŹĒ£ŗµĪ¼Ó¹żĮæBa£ØNO3£©2ČÜŅŗ£¬¹żĀĖŗóĻņĀĖŅŗµĪ¼ÓAgNO3ČÜŅŗ£®


 ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø
ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĶ©Šæ©ĮņĖį¹¹³ÉµÄŌµē³ŲÖŠ£¬µ±µ¼ĻßÖŠÓŠ1molµē×ÓĶعżŹ±£¬ĄķĀŪÉĻµÄĮ½¼«±ä»ÆŹĒ£Ø £© ¢ŁŠæʬČܽā32.5g ¢ŚŠæʬŌöÖŲ32.5g ¢ŪĶʬÉĻĪö³ö1gH2¢ÜĶʬÉĻĪö³ö1mol H2 £®
A.¢Ł¢Ū
B.¢Ł¢Ü
C.¢Ś¢Ū
D.¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°¢·üŁ¤µĀĀŽ³£ŹżŌ¼ĪŖ6.02”Į1023 mol©1 £¬ ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.2.3 gÄĘÓė×ćĮæ±ūČż“¼·“Ó¦£¬×ŖŅʵē×ÓŹżĪŖ0.3”Į6.02”Į1023
B.±ź×¼×“æöĻĀ£¬22.4 LŅŅ“¼µÄ¹²¼Ū¼üŹżĪŖ8”Į6.02”Į1023
C.±ź×¼×“æöĻĀ£¬5.6 L¼×Č©Ėłŗ¬µÄµē×ÓŹżĪŖ4”Į6.02”Į1023
D.100 mL 1 molL©1“×ĖįČÜŅŗÖŠ£¬H+µÄøöŹżĪŖ0.1”Į6.02”Į1023
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀA”¢B”¢CµÄČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ£¬ĒŅ”÷H=”÷H1+”÷H2 £® ŌņA”¢CæÉÄÜŹĒ£Ø £© 
¢ŁFe”¢FeCl3
¢ŚC”¢CO2
¢ŪAlCl3”¢NaAlO2
¢ÜNaOH”¢NaHCO3
¢ŻS”¢SO3
¢ŽNa2CO3”¢CO2 £®
A.¢Ś¢Ū¢Ü¢Ž
B.¢Ś¢Ū¢Ü¢Ż¢Ž
C.¢Ł¢Ś¢Ū¢Ü¢Ž
D.¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĻĀĆęµÄ·“Ó¦Ā·Ļß¼°ĖłøųŠÅĻ¢ĢīæÕ£® 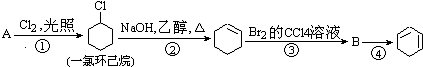
£Ø1£©AµÄ½į¹¹¼ņŹ½ŹĒ £¬ Ćū³ĘŹĒ £®
£Ø2£©¢ŁµÄ·“Ó¦ĄąŠĶŹĒ £¬ ¢ŚµÄ·“Ó¦ĄąŠĶŹĒ £®
£Ø3£©·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀČĘųĶØČėŹÆ»ŅČéÖʵĆĘÆ°×·Ū£¬ĘäÖ÷ŅŖ³É·ÖŹĒCa(OH)2”¤3CaCl( ClO)”¤H2O”£ŅŃÖŖ“ĪĀČĖįŃĪæÉÓėŃĪĖį·“Ӧɜ³ÉĀČĘų£¬ÓĆÖü“ę¹ż¾ĆµÄĘÆ°×·ŪÓėÅØŃĪĖįÖʵƵÄCl2ÖŠ£¬ŗ¬Įæ×ī¶ąµÄŌÓÖŹĘųĢå³żĖ®ÕōĘųĶā£¬»¹æÉÄÜŹĒ
A. HC1£¬O2 B. CO2£¬HCl C. HC1 £¬H2 D. CO2£¬H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫ĪļÖŹXÖš½„¼ÓČė(»ņĶØČė)YČÜŅŗÖŠ,ĘäÉś³É³ĮµķµÄĮæÓė¼ÓČėXµÄĪļÖŹµÄĮæµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾,·ūŗĻĶ¼Ź¾ĒéæöµÄŹĒ( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«Ä³Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬Į½ÖÖČÜŅŗµÄÅضČŗĶ»ģŗĻŗóĖłµĆČÜŅŗµÄpHČē±ķĖłŹ¾£ŗ
ŹµŃ鱹ŗÅ | HAĪļÖŹµÄĮæÅØ¶Č£Ømol*L©1£© | NaOHĪļÖŹµÄĮæÅØ¶Č£Ømol*L©1£© | »ģŗĻČÜŅŗµÄpH |
¢Ł | 0.1 | 0.1 | pH=9 |
¢Ś | c | 0.2 | pH=7 |
¢Ū | 0.2 | 0.1 | pH£¼7 |
Ēė»Ų“š£ŗ
£Ø1£©“Ó¢Ł×éĒéæö±ķĆ÷£¬HAŹĒ£ØĢī”°ĒæĖį”±»ņ”°ČõĖį”±£©£®
£Ø2£©¢Ś×éĒéæö±ķĆ÷£¬c0.2£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£®»ģŗĻŅŗÖŠĄė×ÓÅضČc£ØA©£©Óėc£ØNa+£©µÄ“󊔹ŲĻµŹĒ £®
£Ø3£©“Ó¢Ū×鏵Ńé½į¹ū·ÖĪö£¬ĖµĆ÷HAµÄµēĄė³Ģ¶ČNaAµÄĖ®½ā³Ģ¶Č£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£¬øĆ»ģŗĻČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ £®
£Ø4£©¢Ł×鏵ŃéĖłµĆ»ģŗĻČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc£ØOH©£©ÓėČÜŅŗÖŠµÄc£ØOH©£©Ö®±ČĪŖ £® Š“³öøĆ»ģŗĻČÜŅŗÖŠĻĀĮŠĖćŹ½µÄ¾«Č·½į¹ū£Ø²»ÄܽüĖĘ¼ĘĖć£©£ŗc£ØNa+£©©c£ØA©£©=molL©1 £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X,Y,ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£ŗĻĀĮŠĆčŹöÕżČ·µÄŹĒ£Ø £© 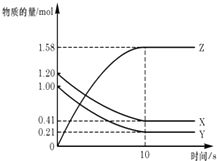
A.·“Ó¦æŖŹ¼µ½10s£¬ÓĆZ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.158mol/£ØLs£©
B.·“Ó¦æŖŹ¼µ½10s£¬XµÄĪļÖŹµÄĮæÅØ¶Č¼õÉŁĮĖ0.79mol/L
C.·“Ó¦æŖŹ¼µ½10sŹ±£¬YµÄ×Ŗ»ÆĀŹĪŖ79.0%
D.·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗX£Øg£©+Y£Øg£©Z£Øg£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com