
����Ŀ��ʵ������Ҫ0.1 mol��L��1 NaOH��Һ490mL��������Һ����������ش��������⡣
(1)����������Һ��Ҫ�IJ����������ձ�������������Ͳ��__________��__________��
(2)����ʱ����ȷ�IJ���˳����(����ĸ��ʾ��ÿ������ֻ��һ��)__________��
A.������ˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B.��ʢ��NaOH������ձ��м�������ˮ��Һ
C.���ձ�������ȴ����Һ�ز�����ע������ƿ��
D.������ƿ�ǽ����������µߵ���ҡ��
E.���ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1��2cm��
(3)ʵ�������õ��������������÷ֱ��ǣ�������__________��������__________��
(4)���ݼ�����������ƽ��ȡNaOH���������Ϊ__________g��
���𰸡�500mL����ƿ ��ͷ�ι� B ![]() C
C ![]() A
A ![]() F
F ![]() E
E ![]() D ���� ���� 2.0
D ���� ���� 2.0
��������
��1���������Ʋ����Ǽ��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ��������
��2���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���Բ���˳���������
��3��������������Ϊ�����裻������
��4��������490mL������ƿ����ѡ��500mL������ƿ������n=cV��m=nM���㡣
ʵ������Ҫ0.1 mol��L��1 NaOH��Һ490mL��û��490mL��������ƿ����������500mL��
��1�����������м��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣨������Ͳ��ȡˮ�����ձ��������ò��������裬�����ܽ⣮��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ���ձ���������2-3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ���������������������ƽ��ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ��ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�
��2���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪��ȷ�IJ���˳����B ![]() C
C ![]() A
A ![]() F
F ![]() E
E ![]() D��
D��
��3���ɣ�2������Һ���Ʋ�����֪��������������Ϊ�����裻������
��4��������490mL������ƿ����ѡ��500mL������ƿ�����Ƴ�500mL��0.1mol/L����Һ������Ҫ���������Ƶ����ʵ���n=cV=0.1mol/L��0.5L=0.05mol������m=nM=0.05mol��40g/mol=2.0g��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ��100 mL 3 mol��L��1��H2SO4��100 mL H2O��ϣ���������ʵ���Ũ��Ϊ1.5 mol��L��1
B. ��100 g 20%��NaCl��Һ��100 g H2O��Ϻ�NaCl��Һ������������10%
C. ��200 mL 3 mol��L��1��BaCl2��Һ��100 mL 3 mol��L��1��KCl��Һ��Ϻ���Һ�е�c(Cl��)��Ȼ��3 mol��L��1
D. ��100 mL 20%��NaOH��Һ��100 mL H2O��Ϻ�NaOH��Һ������������10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ұ��ҵ�������������ָ֣�����Ϊ�������ȥ�������仯����㷺Ӧ���ڵ�ء���е����ҵ������
(1)�����̿�(��ҪΪMnO2)Ϊԭ��ͨ���Ȼ�ԭ���õ��������漰��������Ӧ��
��3MnO2(s)=Mn3O4(s)+ O2(g) ��H1= akJmol-1
��3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) ��H2= bkJmol-1
��֪Al��ȼ����Ϊ ��H3=ckJmol-1����MnO2��Al�������ȷ�Ӧ���Ȼ�ѧ����ʽΪ___________��
(2)������Ա���Ƶõ��̷������뵽SnCl2��Һ��ʹ�����(�ٶ����ʲ���Ӧ����Һ �������)��������ӦMn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(��֪��Sn2+ˮ��ҺΪ��ɫ)
Mn2+(aq)+ Sn(s)(��֪��Sn2+ˮ��ҺΪ��ɫ)
��ش��������⣺
��Ϊ�ӿ췴Ӧ���ʿ��Բ�ȡ�Ĵ�ʩ��__________���������¶����أ�һ��ʱ���Mn���ܽ����ʼӿ죬���ܵ�ԭ����____________________��
��������˵����Ӧ�Ѵ�ƽ�����____________________(����)��
A.��Һ����ɫ�������仯 B.��Һ��c(Mn2+)=c( Sn2+)
C.��ϵ�й������������ D.Mn2+��Sn2+Ũ�ȵı�ֵ���ֲ���
�������£������Һ��������Ũ��c(R2+)��ʱ��ı仯�������ͼ��ʾ����������Ӧ��ƽ�ⳣ��K=________________��Mn2+�IJ���Ϊ____________��
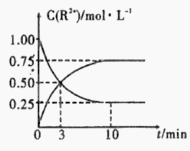
���������������䣬10min����������Ѹ�ټ�������ˮ����Һ�����Ϊԭ����2������ �ٴ�ƽ��ʱc(Mn2+) =____________(����������ˮ���Ӱ��)��
(3)MnO2Ҳ����MnSO4-H2SO4-H2OΪ��ϵ�ĵ��Һ�е���ã���������ӦʽΪ_____________________������������Һ��pH____________(ѡ����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ����ͼ��ʾN2O��Pt2O+������CO��Ӧת����������Ĺ��̡�����˵����ȷ����

A.N2Oת����������ʱ�Ĵ�����Pt2O2+
B.ÿ1mol Pt2O+ת��ΪPt2O2+�õ�����Ϊ3NA
C.�����ɵ�CO2ͨ�˺�����SiO32-��Na+��Cl-����Һ�У�����������
D.1g CO2 ��N2O�Ļ�������к��е�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��H2 ��Cl2 ��Ӧ����HCl�������仯ʾ��ͼ����ͼ��֪��������
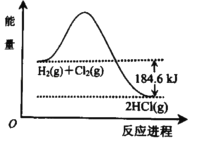
A. ��Ӧ��������ܺ�С�������������
B. ����1molHCl��g��������92.3kJ������
C. H2��g��+Cl2��g����2HCl��g����H����184.6 kJmol��1
D. H2��g��+Cl2��g����2HCl��g����H����184.6 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ȼ����±���������ķ�Ӧ��ͼ��ʾ��(��С���Ӳ�����ȥ)������˵����ȷ����

A. �÷�Ӧ���ڻ��Ϸ�Ӧ
B. b�Ķ��ȴ�����6�ֽṹ
C. 1mol b�������ɱ�������Ҫ6molH2
D. C5H11Cl�Ľṹ��8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����Ǹ��л�ѧ�г��õ�������������������й����ݡ�
(1)���Ⱥ��п�����(��ѧʽΪC8H10N4O2)�������Ħ������Ϊ__________g/mol��
(2)0.2 g H2��Լ����________��Hԭ�ӡ�
(3)100 mLijAl2(SO4)3��Һ�У�c(Al3��)��2.0 mol/L������c(SO42��)�� ________mol/L��
(4)8 ��O2��O3�Ļ����������ԭ�ӵ����ʵ���Ϊ ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ����ʾ��ʵ���У��ܴﵽʵ��Ŀ�ĵ��ǣ� ��
|
|
A. �Ʊ� | B. �Ƚ� |
|
|
C. ���ȷ��Ʊ����������� | D. ��ˮ���ռ����� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��R��X��YΪԭ��������������Ķ���������Ԫ�أ�Z��һ�ֹ���Ԫ�ء�M��̬ԭ��L����p�����������s�����������2����R��ͬ����Ԫ��������õĽ���Ԫ�أ�X��M�γɵ�һ�ֻ������������������Ҫ������Ⱦ�Z�Ļ�̬ԭ��4s��3d������������ش��������⣺
��1��R��̬ԭ�ӵĵ����Ų�ʽ��_____��X��Y�е縺�Խϴ����__����Ԫ�ط��ţ���
��2��X���⻯��ķе��������������Ƶ�M���⻯���ԭ����___________��
��3��X��M�γɵ�XM3���ӵĿռ乹����__________��
��4��M��R���γɵ�һ�����ӻ�����R2M����ľ�����ͼ��ʾ����ͼ�к��������������_________�������ӷ��ţ���
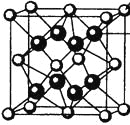
��5����ϡ�����У�Z����ۺ�����ļ��Σ���ɫ������M��һ���⻯�Z����ԭΪ+3�ۣ��÷�Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com