

 .
. .
.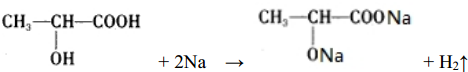 .
. .
. .
. 分析 I、由图中转化可知,乙烯燃烧生成二氧化碳和水,A为水解产物,且A可发生酒化反应生成B和甲,则甲为CO2,乙为H2O,A为葡萄糖,B可发生连续氧化反应,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E为CH3COOC2H5;
II、 中含-OH、-COOH,结合醇、羧酸的性质来解答.
中含-OH、-COOH,结合醇、羧酸的性质来解答.
解答 解:(1)C物质的结构简式为CH3CHO,故答案为:CH3CHO;
(2)②为分解反应,③④为氧化反应,⑤为取代反应或酯化反应,⑥光合作用,⑦为氧化反应,⑧为乙烯的加成反应,故答案为:⑤;
(3)由上述分析可知,只有⑧为加成反应,故答案为:⑧;
(4)A为葡萄糖,含-CHO,向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是有(砖)红色沉淀产生,故答案为:有(砖)红色沉淀产生;
(5)B+D→E的反应为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;
(6)乙烯生成聚乙烯的反应为为 ,故答案为:
,故答案为: ;
;
(7)乳酸分子中含羧基、羟基两种官能团,故答案为:羧基、羟基;
(8)含-OH、-COOH,均与Na反应,则反应为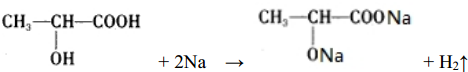 ,
,
故答案为: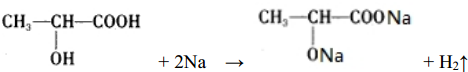 ;
;
(9)只有-COOH与碳酸钠反应,则反应为 ,
,
故答案为: ;
;
(10)含-OH、-COOH可发生酯化反应,则两分子相互发生酯化反应生成环状酯,此环状酯的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成及推断,为高频考点,把握流程中官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| a | ||
| b | ||
| c |
| A. | 氯、氟、硫 | B. | 氟、硫、砷 | C. | 氦、氟、氯 | D. | 氖、氯、硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
. 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②的溶液变黄的原因是反应产生Fe3+ | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com