
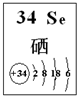
 根据表中信息回答下列问题.
根据表中信息回答下列问题.| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 |
高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI═Se↓+2I2+3H2O |
| 2 | ||
| 3 |
| 2 | 还原性 | 2H2SeO3+O2═2H2SeO4 (或Br2+H2SeO3+H2O═H2SeO4+2HBr) |
| 3 | 酸性 | H2SeO3+2NaOH═Na2SeO3+2H2O |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、I a |
| B、I b |
| C、II b |
| D、III c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A元素在地壳中的含量居第四位 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 | ||
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成多种化合物 | ||
| ⑥ | F | F的其中一种核素中无中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为五种短周期元素,且原子序数依次增大.其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数.C原子的最外层中有两个不成对的电子.D、E的原子核内各自的质子数与中子数相等.C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素).已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1.请回答下列问题:
A、B、C、D、E为五种短周期元素,且原子序数依次增大.其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数.C原子的最外层中有两个不成对的电子.D、E的原子核内各自的质子数与中子数相等.C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素).已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
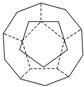 I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若高分子对应的单体只有一种,则此高聚物与单体有相同的最简式 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升低 |
| C、有一种信息素的结构简式为CH3 (CH2)5CH═CH(CH2)9CHO,为验证该物质中既含有醛基又含有碳碳双键,向该物质的试液中先加过量的溴水溶液,观察到溶液褪色,再向溶液中加入新制的Cu(OH)2悬浊液,加热煮沸,观察到砖红色沉淀 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com