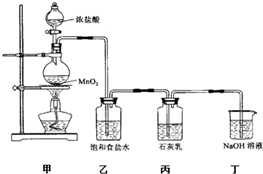
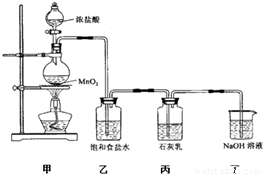
�⣺��1������������Ũ�����ڼ��ȵ������·�Ӧ�����Ȼ��̡�������ˮ��
��Ӧ����ʽΪ��MnO
2+4HCl

MnCl
2+Cl
2��+2H
2O��
�ʴ�Ϊ��MnO
2+4HCl

MnCl
2+Cl
2��+2H
2O��
��2���Ȼ����ӷ�����ȡ�������к���HCl��Ӱ��������Ӧ�����̽�����ñ���ʳ��ˮ��ȥ�����л��е��Ȼ��⣻
ʵ��β���к���δ��Ӧ�������������ж���ֱ���ſգ�����Ⱦ����������������������Һ���գ�
�ʴ�Ϊ����ȥ�����л��е��Ȼ��⣻����Cl
2��ֹ��Ⱦ������
��3��8.7gMnO
2�����ʵ���Ϊ
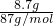
=0.1mol�����ݷ���ʽMnO
2+4HCl

MnCl
2+Cl
2��+2H
2O��֪��MnO
2��ȫ��Ӧ��ҪHCl�����ʵ���Ϊ0.4mol��С��0.1L��12mol?L
-1=1.2mol���ʶ���������ȫ��Ӧ���ɷ���ʽ��֪��������0.1mol���ɷ���ʽ2Cl
2+2Ca��OH��
2=CaCl
2+Ca��ClO��
2+2H
2O��֪��0.1mol������ȫ��Ӧ����0.05molCa��ClO��
2��
����Ϊ0.05mol��143g��mol=7.15g��
�ʴ�Ϊ��7.15g��
��4������Ŀ��Ϣ��֪�������ͼ�ķ�ӦΪ���ȷ�Ӧ���¶ȹ��ߣ������ͼӦ�����������Σ����´������εIJ��ʽ��ͣ����Խ���װ�ý���ʢ����ˮ��ˮ���н����¶ȣ�
�ʴ�Ϊ������װ�ý���ʢ����ˮ��ˮ���У�
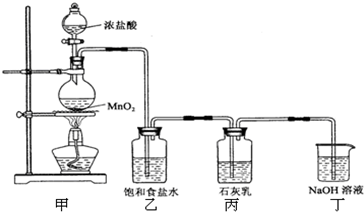
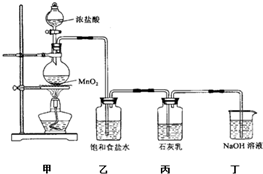
��������1��װ�ü��������ķ���װ�ã�����������Ũ�����ڼ��ȵ������·�Ӧ�����Ȼ��̡�������ˮ��
��2���Ȼ����ӷ�����ȡ�������к���HCl��Ӱ��������Ӧ�����̽����
ʵ��β���к���δ��Ӧ�������������ж���ֱ���ſգ�����Ⱦ����������������������Һ���գ�
��3�����ݹ��������ж����ᡢ������������һ��ʣ�࣬���ݲ�������ʼ������ɵ��������ڸ��ݷ���ʽ�������ɵ�
Ca��ClO��
2������
��4������Ŀ��Ϣ��֪�������ͼ�ķ�ӦΪ���ȷ�Ӧ���¶ȹ��ߣ������ͼӦ�����������Σ����´������εIJ��ʽ��ͣ���Ӧ����װ�����ڵ��»�����
������������������ȡ�����������ʡ��Է�Ӧװ�õ����⡢��Ӧ�����Ŀ��Ƶȣ��Ѷ��еȣ�ע�⣨3���й������㣮

 ij��ȤС�����������ʵ��װ��̽��������ʯ���鷴Ӧ�������Ͳ��
ij��ȤС�����������ʵ��װ��̽��������ʯ���鷴Ӧ�������Ͳ�� 5NaCl+NaClO3+3H2OΪ�����Ca��ClO��2�IJ��ʣ��ɶԱ�װ�����ʵ��Ľ����������һ�ָĽ�������______��
5NaCl+NaClO3+3H2OΪ�����Ca��ClO��2�IJ��ʣ��ɶԱ�װ�����ʵ��Ľ����������һ�ָĽ�������______�� MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O�� MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��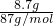 =0.1mol�����ݷ���ʽMnO2+4HCl
=0.1mol�����ݷ���ʽMnO2+4HCl MnCl2+Cl2��+2H2O��֪��MnO2��ȫ��Ӧ��ҪHCl�����ʵ���Ϊ0.4mol��С��0.1L��12mol?L-1=1.2mol���ʶ���������ȫ��Ӧ���ɷ���ʽ��֪��������0.1mol���ɷ���ʽ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��֪��0.1mol������ȫ��Ӧ����0.05molCa��ClO��2��
MnCl2+Cl2��+2H2O��֪��MnO2��ȫ��Ӧ��ҪHCl�����ʵ���Ϊ0.4mol��С��0.1L��12mol?L-1=1.2mol���ʶ���������ȫ��Ӧ���ɷ���ʽ��֪��������0.1mol���ɷ���ʽ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��֪��0.1mol������ȫ��Ӧ����0.05molCa��ClO��2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
 ij��ȤС�����������ʵ��װ��̽��������ʯ���鷴Ӧ�������Ͳ��
ij��ȤС�����������ʵ��װ��̽��������ʯ���鷴Ӧ�������Ͳ��