
【题目】下列各种叙述中正确的是( )
A. 在任何条件下,纯水的pH=7 B. 在任何条件下,纯水都呈中性
C. 在90℃时,纯水中pH=7 D. 在50℃时,纯水c(H+)<10-7mol/L
【答案】B
【解析】A.水的电离是吸热反应,常温下水的pH等于7,温度升高,水的电离程度增大,pH=-lg c(H+),100℃时,纯水的c(H+)=1×10-6mol/L,pH=-lg1×10-6=6,故A错误;B.水的电离方程式为:H2O![]() H++OH-,所以在任何条件下,纯水的c(H+)=c(OH-),呈中性,故B正确;C.90℃时,水的Kw=1×10-12,水的电离方程式为:H2O
H++OH-,所以在任何条件下,纯水的c(H+)=c(OH-),呈中性,故B正确;C.90℃时,水的Kw=1×10-12,水的电离方程式为:H2O![]() H++OH-,则c(H+)c(OH-)=1×10-12,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)=1×10-6mol/L,该温度下,所以纯水的pH=-lg1×10-6=6,故C错误;D.50℃时,水的Kw>1×10-14,水的电离方程式为:H2O
H++OH-,则c(H+)c(OH-)=1×10-12,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)=1×10-6mol/L,该温度下,所以纯水的pH=-lg1×10-6=6,故C错误;D.50℃时,水的Kw>1×10-14,水的电离方程式为:H2O![]() H++OH-,则c(H+)c(OH-)= Kw>1×10-14,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)>1×10-7mol/L,故D错误;故选B。
H++OH-,则c(H+)c(OH-)= Kw>1×10-14,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)>1×10-7mol/L,故D错误;故选B。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
气体体积/L | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯可以通过下列方法合成:
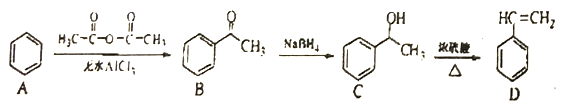
(1)A![]() B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
(2)C中含氧官能团的名称是________;C物质能与CH3COOH在浓硫酸作用下,发生酯化反应,写出相应化学反应方程式_______
(3)检验产物D中溶有C的实验方法是______。
(4)B有多种同分异构体:E是B的芳香类同分异构体,结构上满足下列条件。则E的结构简式为_________。
A.能发生银镜反应 B.且苯环上的一氯代物只有2种
(5)对羧基聚苯乙烯(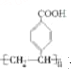 )是合成功能高分子材料的重要中间体。
)是合成功能高分子材料的重要中间体。
己知:①NaBH4为选择性还原剂,不能还原羧酸
②苯甲酸发生苯环取代时,生成间位产物.
试写出以甲苯等为主要原料,合成对羧基聚苯乙烯的流程图(无机试剂任选)合成路线流程图示例如下:![]() _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1mol/L FeCl3溶液,对比观察现象.” Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色.
(4)Ⅱ.探讨FeCl3催化H2O2分解的机理 Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对 ![]() X与
X与 ![]() X+两种微粒,下列叙述正确的是( )
X+两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.质子数一定相同,质量数和中子数一定不相同
C.核电荷数和核外电子数一定相等
D.化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 12C和14C互为同位素
B. 甲烷与正丁烷(CH3CH2CH2CH3)互为同系物
C. 二氧化碳和干冰互为同素异形体
D. 乙醇(CH3CH2OH)与二甲醚(CH3OCH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
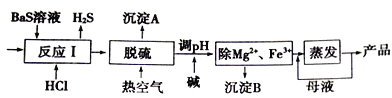
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.液氨在工业上经常作制冷剂使用
B.碳酸氢铵的俗名是碳铵
C.工业硝酸常因溶有少量的Fe3+而略显黄色
D.NO2不但能形成酸雨,在日光照射下,还能使氧气经过复杂的反应生成O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com