
如下图所示的物质的转化关系中,A是一种固体单质,E是一种白色沉淀。据图填写:
(1) B的化学式是_________,目前B已被用作___________的主要原料。
(2) B和a溶液反应的离子方程式是_____________________________。
(3) A和a溶液反应的化学方程式是_____________________________。
(4) C和过量盐酸反应的离子方程式是____________________________。
 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
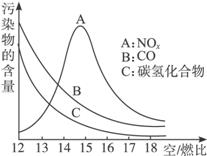
(1)稀薄冰燃烧技术除能节约能源外,还具有的优点是___________(填一项)。排放到大气中的NOx会导致酸雨、___________等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同、在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是___________。
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体。②汽车尾气。消耗NH3的物质的量较多的可能是___________ (填字母),原因是___________。
A.① B.② C.都有可能
查看答案和解析>>
科目:高中化学 来源:2014届云南省昆明市高三上学期第一次摸底调研测试化学试卷(解析版) 题型:填空题
工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。

完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异 b溶解性差异 c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
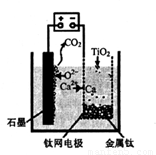
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三上学期第四次月考化学试卷 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
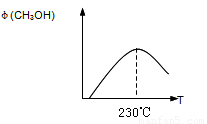
(1)合成甲醇的反应为:
CO(g)+2H2(g)CH3OH(g);△H
下图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、< 或 = ”)
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中Cu极为 极;写出b极的电极反应式 ,当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。

|
难(微)溶物 |
溶度积常数(Ksp) |
|
BaSO4 |
1×10-10 |
|
BaCO3 |
2.6×10-9 |
|
CaSO4 |
7×10-5 |
|
CaCO3 |
5×10-9 |
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
具体做法是用饱和纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
有两条途径可以使重晶石(BaSO4)转化为碳酸钡,如下图所示:
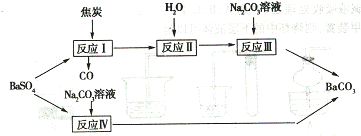
试回答下列问题:
(l)反应I 中发生的主要反应为:BaSO4 + 4C = BaS + 4CO ,若1 mol BaSO4 完全反应,电子转移的物质的量为 ;
(2)Na2CO3 溶液的pH 大于10 ,用离子方程式说明其主要原因 ,其溶液中离子浓度由大到小的顺序是 ;
(3)已知反应IV 中发生的反应为:BaSO4 ( s ) + CO3 2- ![]() BaCO3 ( s ) + SO42- ,写出此反应平衡常数表达式K = ;若KSP (BaSO4)为
BaCO3 ( s ) + SO42- ,写出此反应平衡常数表达式K = ;若KSP (BaSO4)为![]()
![]() ,KSP (BaCO3)为
,KSP (BaCO3)为![]() ,则K 的值为 ;
,则K 的值为 ;
(4)若每次加入1L 2mol · L-1的Na2CO3溶液,至少需要 次可以将0.2mol BaSO4转化为BaCO3 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com