考点:化学平衡状态的判断,氧化还原反应方程式的配平,热化学方程式,化学平衡的影响因素,离子浓度大小的比较
专题:氧化还原反应专题,化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(2)根据得失电子守恒和原子守恒配平,用单线桥标出电子的数目;
(3)①常温下,N
2H
6C1
2溶液水解导致溶液呈酸性,所以水电离出的氢离子等于等于溶液中的氢离子;
②已知在相同条件下过程I的进行程度大于N2H5’的水解程度.常温下,若0.2mol/L,N
2H
4溶液与0.1mol/L HCl溶液等体积混合,则生成等物质量浓度的N
2H
4和N
2H
5Cl溶液以N
2H
4 ,N
2H
4+H
2O?N
2H
5++OH
-Ⅰ为主,所以溶液呈碱性,即离子浓度大小的顺序为:c(N
2H
5+)>c(Cl
-)>c(OH
-)>c(H
+);
(4)①根据图象中氮气的产率变化可知,若反应b从1000℃变为1100℃,NO产率减少,平衡常数减小,则K
1>K
2;
②反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
③A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
不变;
B.增大容器体积,相当于减压,平衡右移,
增大;
C.恒容条件下,充入N
2H
4,平衡右移,
增大;
D.使用催化剂,平衡不移动,
不变.
解答:
解:(1)1.6g即0.05mol的 N
2H
4(l)在上述反应中放出64.22kJ的热量,则1mol放出的热量为
×64.22kJ=1284.4kJ,所以热化学方程式为:N
2H
4(l)+2H
2O
2(l)=N
2(g)+4H
2O (g)△H=-1284.4kJ/mol,
故答案为:N
2H
4(l)+2H
2O
2(l)=N
2(g)+4H
2O (g)△H=-1284.4kJ/mol;
(2)N
2H
4中氮由-2价变成0价,升高2×2=4,NO
2中氮由+4价变成0,降低4,所以N
2H
4和NO
2的计量数相等,然后根据原子守恒,方程为:
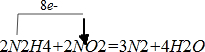
,故答案为:2;2;3;4;
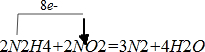
;
(3)①常温下,N
2H
6C1
2溶液是强酸弱碱盐,水解导致溶液呈酸性,所以水电离出的氢离子等于等于溶液中的氢离子,c(H
+)=1×10
-4mol/L,故答案为:1×10
-4mol/L;
②已知在相同条件下过程I的进行程度大于N2H5’的水解程度.常温下,若0.2mol/L,N
2H
4溶液与0.1mol/L HCl溶液等体积混合,则生成等物质量浓度的N
2H
4和N
2H
5Cl溶液以N
2H
4 ,N
2H
4+H
2O?N
2H
5++OH
-Ⅰ为主,所以溶液呈碱性,即离子浓度大小的顺序为:c(N
2H
5+)>c(Cl
-)>c(OH
-)>c(H
+),
故答案为:c(N
2H
5+)>c(Cl
-)>c(OH
-)>c(H
+);
(4)①根据图象中氮气的产率变化可知,若反应b从1000℃变为1100℃,NO产率减少,平衡常数减小,则K
1>K
2,故答案为:>;
②A.v(N
2)=v(N
2H
4),未体现正逆反应的关系,故不选;
B.c(N
2H
4):c(O
2):c(N
2)=1:1:1,而不是不变,故不选;
C.体系的压强不再发生变化,说明气体物质的量不变,已达平衡,故选;
D.混合气体的平均相对分子质量不再发生变化,说明气体物质的量不变,已达平衡,故选;
故选CD;
③A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
不变;
B.增大容器体积,相当于减压,平衡右移,
增大;
C.恒容条件下,充入N
2H
4,平衡右移,
增大;
D.使用催化剂,平衡不移动,
不变;
故选BC.
点评:本题考查了影响化学反应速率和化学平衡的因素、平衡常数的计算等,题干信息的应用和分析判断是解题关键,题目难度中等.

 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.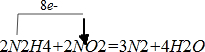 ,故答案为:2;2;3;4;
,故答案为:2;2;3;4;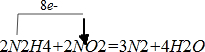 ;
;

 优生乐园系列答案
优生乐园系列答案

