
已知氧化性Ag+>Fe3+,将铁粉投入到盛Cu2+、Ag+、Fe3+的溶液中,反应完毕时,若烧杯底部有铁粉剩余,溶液中一定不存在的金属离子是__________;若烧杯中无铁粉剩余,则溶液中一定含有的金属离子是____________;若溶液中不含Cu2+,则一定不含有的金属离子是________。
科目:高中化学 来源: 题型:
已知下列反应:①HPO3+H2O===H3PO4;②2Na2O2+2H2O===4NaOH+O2↑;③2F2+2H2O===4HF+O2;④2K+2H2O===2KOH+H2↑;⑤Cl2+H2O===HCl+HClO;⑥2H2O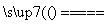 2H2↑+O2↑。
2H2↑+O2↑。
其中,H2O只做氧化剂的是________;H2O只做还原剂的是________;H2O既做氧化剂,又做还原剂的是________;H2O既不是氧化剂,又不是还原剂的是________,其中不属于氧化还原反应的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国农业生产因遭受酸雨而造成的损失每年高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区划分方案》等法规。
(1)某实验小组采集酸雨样品,随着时间的推移,多次测定该样品pH,得到了如下数据:
| 时间(t) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
简答:
①酸雨样品放置时pH变化的主要原因(用化学方程式表示):____________________。
②如果将刚取样的上述酸雨和自来水混合,pH将______(“增大”、“减小”或“不变”),原因是(用化学方程式表示)_______________________________________。
(2)酸雨可导致下列哪些危害( )
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
(3)你认为减少酸雨产生的途径可采取的下列措施是( )
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
(4)为了防治酸雨,减少煤燃烧时向大气排放的二氧化硫,火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收,制成有用的石膏CaSO4·2H2O,则有关反应的化学方程式:___________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
制印刷电路板时常用FeCl3溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2,向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应、结晶、过滤、干燥产物;④电解;⑤得到产物。下列关于提取镁的说法中,不正确的是( )
A.此法的优点之一是原料取自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解法冶炼金属要消耗大量电能
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。
海水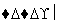

试回答下列问题:
(1)写出用海滩上的贝壳制备Ca(OH)2的化学方程式:_________________________
________________________________________________________________________。
(2)写出电解饱和NaCl溶液的化学方程式:__________________________________。
(3)将电解生成的氯气通入石灰乳可制得漂白粉,其反应的化学方程式为:_______
________________________________________________________________________。
(4)用海滩上的贝壳制Ca(OH)2而不从异地山中开凿石灰石制取,主要考虑到什么问题?
________________________________________________________________________。
(5)从经济效益角度看,该化工厂的厂址应选择在
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有等物质的量的铜和银的混合物17.2 g,与50.0 mL
的浓硝酸恰好完全反应,
产生气体4.48 L(标准状况),则下列说法正确的是
A.产生的气体是0.2 mol NO2
B.硝酸的物质的量浓度为12 mol·L-1
C.反应中被还原和未被还原的硝酸物质的量之比为3∶2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com