
| A. | 0.1 molNa2O2 晶体中所含的离子总数为0.4NA | |
| B. | 在含4mol Si-O键的石英晶体中,氧原子的数目为2NA | |
| C. | 1molCl2发生反应时,转移的电子数一定为0.2NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、1mol二氧化硅中含4molSi-O键;
C、氯气反应后的价态不明确;
D、溶液体积不明确.
解答 解:A、过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含离子共0.3mol即0.3NA个,故A错误;
B、1mol二氧化硅中含4molSi-O键,故当含4molSi-O键时,二氧化硅的物质的量为1mol,则含2mol氧原子即2NA个,故B正确;
C、氯气反应后的价态不明确,故1mol氯气反应后转移的电子的物质的量和个数无法计算,故C错误;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液中:Na+、K+、MnO4-、[Al(OH)4]- | |
| B. | 水电离出的[H+]=10-14mol/L溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 加入铝能产生H2的溶液中:K+、NH4+、I-、NO3- | |
| D. | 常温下c(OH-)=10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化碳的排放会导致酸雨的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
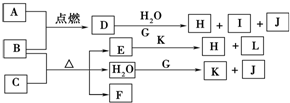
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 中国药学家屠呦呦因青蒿素而获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列说法不正确的是( )
中国药学家屠呦呦因青蒿素而获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列说法不正确的是( )| A. | 该物质易溶于冷水 | B. | 能够发生水解反应 | ||
| C. | 每个分子中含有3个六元环 | D. | 青蒿素具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8 g | B. | 5.4 g | C. | 6.0 g | D. | 6.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com